Variabilidad morfológica de Jania longifurca (Corallinales, Rhodophyta) en Galicia (noroeste de España)
Juan LUGILDE 1,*, Ignacio BÁRBARA 2 & Viviana PEÑA 3
1,2,3 Grupo de investigación BioCost, Universidade da Coruña, Facultad de Ciencias, Campus da Zapateira s/n, 15071 La Coruña, España.
* Enlace: juan.lugilde@udc.es, https://orcid.org/0000-0001-9302-6733
2 ignacio.barbara@udc.es, https://orcid.org/0000-0003-1779-0224
3 vpena@udc.es, https://orcid.org/0000-0001-7003-3850
| |
Resumen
Título en inglés: Morphological variability of Jania longifurca (Corallinales, Rhodophyta) in Galicia, northwestern Spain.
En los fondos de maerl de Galicia se detectó material de Jania J.V.Lamour. con una morfología distinta de la típica atribuida a J. longifurca Zanardini y J. rubens (L.) J.V.Lamour. —únicas especies citadas en este hábitat en Galicia—. Esta consiste en: intergenículos delgados, ramificación dicotómica irregular y discos secundarios que facilitan la refijación al substrato, caracteres congruentes con los de otras especies de Jania de distribución más meridional. No obstante, el estudio taxonómico integrador de este material y de otras recolecciones de hábitat rocoso confirmó su identificación como J. longifurca. Así, la morfología atípica con intergenículos delgados y discos secundarios de fijación es dominante en ejemplares de J. longifurca procedentes de fondos de maerl, mientras que los ejemplares de ambientes rocosos presentan los típicos intergenículos robustos. Por otra parte, análisis moleculares detectaron cierta afinidad filogenética de J. longifurca con ejemplares de Nueva Zelanda, donde esta especie no está citada. Se concluye entonces que la variación morfológica en J. longifurca está relacionada con el ambiente y se evidencia la necesidad de estudios moleculares para esclarecer la taxonomía de este género, que está basada fundamentalmente en caracteres morfológicos.
Palabras clave. Algas coralinas, Atlántico ibérico, código de barras de la vida, costas rocosas, fondos de maerl, Jania, taxonomía integrativa, variaciones morfológicas.
|
| |
Abstract
Material of Jania J.V.Lamour. with a different morphology from the typical one attributed to J. longifurca Zanardini and J. rubens (L.) J.V.Lamour.—the only species in this habitat in Galicia—has been detected in the maerl beds of Galicia. This morphology consists on: thin intergenicula, an irregular pattern of dichotomies and secondary attachment discs that facilitate the refixation to the substrate, all of them similar to those of other southern species of Jania. Nevertheless, the integrative taxonomic study of this material and other collections from rocky habitat confirmed its identification as J. longifurca. Thereby, the atypical morphology with thin intergenicula and secondary attachment disc is dominant in samples of J. longifurca from maerl beds, while the samples from rocky environments showed the typical robust intergenicula. Moreover, molecular analysis resolved some phylogenetic affinities with samples from New Zealand, where this species is not recorded. It is concluded therefore the morphological variation related to the environment and it is evident the need of molecular studies to clarify this genus taxonomy, which is based fundamentally on morphological characters.
Keywords. Atlantic Iberian, coralline algae, DNA barcoding, integrative taxonomy, Jania, maerl beds, morphological variations, rocky shores.
|
INTRODUCCIÓNTOP
El género Jania J.V.Lamour. —Corallinales P.C.Silva & H.W.Johans., Rhodophyta Wettst.— se caracteriza por presentar talos articulados —geniculados— y con ramificación fundamentalmente dicótoma. Representado por 48 especies ampliamente distribuidas en regiones templadas y tropicales, este género está considerado como uno de los más diversos (Woelkerling & al. 2015a; Guiry & Guiry 2019). Si bien la posición sistemática del género dentro de la subfamilia Corallinoideae (Aresch.) Foslie ha sido bien definida de acuerdo con sus relaciones filogenéticas (Kim & al. 2007), los estudios taxonómicos en Jania resultan complejos debido a la falta de información acerca del material tipo de numerosas especies (v. gr., Woelkerling & al. 2015a, 2015b, 2015c) y a la gran variabilidad morfológica descrita dentro de una misma especie (v. gr., Areschoug 1852; Yendo 1902; Børgesen 1917; Taylor 1945). Así, una variedad ampliamente distribuida de la especie tipo del género —J. rubens (L.) J.V.Lamour.—, J. rubens var. corniculata (L.) Yendo, se caracteriza por presentar lóbulos distales —cornículos— en los intergenículos, que faltan en la variedad tipo
(Yendo 1905). Por otra parte, J. rubens puede desarrollar discos secundarios (Hamel & Lemoine 1952), estolones o ramas divaricadas y enredadas (Irvine & Chamberlain 1994). En esta especie, también se observó cierta variabilidad morfológica relacionada con el desarrollo de conceptáculos y el ambiente (Ardré 1970; Irvine & Chamberlain 1994), de la misma manera que Cabioch (1972) observó el desarrollo de ramificaciones delgadas o talos intrincadamente ramificados desde la base del talo, que interpretó como propágulos o estructuras de enlace. Así, la dificultad para diferenciar especies en Jania con un criterio exclusivamente morfológico ha sido discutida por numerosos autores (v. gr., Dawson 1953; Villena-Balsa & al. 1987; Afonso-Carrillo & Sansón 1999; Cormaci & al. 2017).
En el Atlántico ibérico, Islas Británicas y Atlántico francés, se conocen cinco táxones de Jania —revisados en Lugilde & al. (2017)—: J. longifurca Zanardini, J. rubens, J. rubens var. corniculata, J. squamata (L.) J.H.Kim, Guiry & H.G.Choi y J. virgata (Zanardini) Mont. En cambio, de Macaronesia y el Mediterráneo se conocen muchos más —revisados en Lugilde & al. (2016) y Cormaci & al. (2017)—, a saber: J. adhaerens J.V.Lamour., J. capillacea Harv., J. cubensis Mont. ex Kütz., J. cultrata (Harv.) J.H.Kim, Guiry & H.G.Choi, J. micrarthrodia J.V.Lamour., J. pumila J.V.Lamour. y J. tenella (Kütz.) Grunow., además de J. verrucosa J.V.Lamour., cuya clasificación es objeto de discusión (Woelkerling & al. 2015a, 2015b).
Durante la revisión de material de herbario del género Jania de Galicia, descubrimos en algunos ejemplares procedentes de fondos submareales de maerl hábitos con ramas delgadas irregularmente dicotómicas, decusadas y divaricadas, que portaban discos secundarios. Esta morfología no coincidía con las descritas para las especies previamente citadas del Atlántico ibérico, pero mostraban parecido con las reportadas para algunas especies de Jania más meridionales. Aunque las únicas especies de Jania identificadas hasta el presente en los fondos de maerl de Galicia son J. longifurca y J. rubens, estos hábitats destacan por presentar una elevada biodiversidad, con especies exclusivas o muy raramente encontradas en otros hábitats (Peña & al. 2014). Por todo lo dicho, el presente trabajo fue diseñado con el propósito de combinar evidencias genéticas y morfológicas que determinasen si la variabilidad morfológica observada se correspondía con el rango de variabilidad intraespecífica de las mencionadas especies o si, por el contrario, nos encontrábamos ante una tercera especie no registrada hasta ahora en el área estudiada.
MATERIAL Y MÉTODOSTOP
Selección de materialTOP
Se trabajó con material del género Jania conservado en el herbario SANT, recolectado en varios fondos de maerl de Galicia y que presentaba una morfología diferente a la descrita en Lugilde & al. (2017). También se estudió material adicional gallego, epífito o que crecía sobre roca. Para los análisis morfo-anatómicos y filogenéticos, se seleccionaron ejemplares de J. longifurca y J. rubens con diferente morfología, a la vez que se descartaron aquellos que correspondían a J. squamata, J. rubens var. corniculata y J. virgata, porque presentaban caracteres diferenciales muy claros y no habían sido citadas en fondos de maerl.
Estudio morfo-anatómicoTOP
La observación del patrón de ramificación, el diámetro de los ejes y las ramas, así como la presencia de discos secundarios en el material seleccionado se llevó a cabo con estereomicroscopio y microscopio óptico. Con el objeto de estudiar los caracteres morfo-anatómicos internos se realizaron secciones del talo con inclusión en gelatina, siguiendo Cremades & al. (1997).
Estudio filogenéticoTOP
Se seleccionaron diez ejemplares considerados correspondientes a J. longifurca —siete con la morfología de fondo de maerl y cuatro con la morfología robusta típica de roca— y cuatro ejemplares considerados correspondientes a J. rubens. De cada ejemplar, se seleccionaron fragmentos libres de epífitos con el estereomicroscopio. Para la extracción de ADN, se utilizó el equipo NucleoSpin® Tissue —Macherey-Nagel, GmbH and Co. KG, Alemania—, de acuerdo con el protocolo del fabricante. Se amplificó mediante PCR el gen plastídico psbA de acuerdo con Bittner (2009) y Peña & al. (2015a); el producto fue purificado mediante ExoSAP y enviado a secuenciar a los servicios de apoyo a la investigación de la Universidade da Coruña. Las secuencias obtenidas se editaron usando Geneious R11 —Biomatters Ltd., Nueva Zelanda— y se alinearon en Seaview (Guoy & al. 2010). Las secuencias fueron enviadas a la plataforma BOLD —http://www.boldsystems.org; Ratnasingham & Hebert (2007)— y GenBank (Tabla 1). Para los análisis filogenéticos, se incluyeron secuencias complementarias, no publicadas hasta ahora, de J. longifurca y J. rubens con morfología típica y procedentes de hábitats rocosos de Galicia, así como secuencias disponibles en GenBank del género Jania. Corallina officinalis L. fue empleada como grupo externo. Las relaciones filogenéticas fueron inferidas utilizando los métodos de máxima verosimilitud e inferencia bayesiana, mediante los programas Mega 6 y MrBayes 3.2.1, respectivamente (Ronquist & Huelsenbeck 2003; Tamura & al. 2013). Los modelos de evolución se estimaron mediante el uso de los índices Akaike y Bayesiano, estimados en jModeltest 2.1.3 (Darriba & al. 2012). Los análisis fueron realizados bajo un modelo de evolución GTR+G. Los análisis bayesianos fueron realizados bajo este mismo modelo de evolución con cuatro cadenas Markov Monte Carlo para diez millones de generaciones con remuestreo cada mil generaciones.
Tabla 1. Especímenes y secuencias de ADN de J. longifurca Zanardini y J. rubens (L.) J.V.Lamour. utilizadas en el presente estudio. [T, morfología típica; A, morfología atípica.]
| Especie |
Hábitat |
Testimonios de herbario |
N.º acceso Genbank, ejemplar |
| J. longifurca (A) |
maerl |
Pontevedra, Punta Barbafeita, 23/XI/2010, I. Bárbara, R. Barreiro, C. Pardo y V. Peña s.n. leg. (SANT-Algae 32486) |
MK308531, JL503
MK308534, JL504 |
| J. longifurca (A) |
maerl |
Pontevedra, Con de Pego, 05/IV/2011, I. Bárbara, R. Barreiro, C. Pardo y V. Peña s.n. leg. (SANT-Algae 32485) |
MK308533, JL506 |
| J. longifurca (T) |
roca |
La Coruña, La Coruña: Playa de Seaia, Malpica, 15/IV/2017, J. Lugilde s.n. leg. (SANT-Algae 32490) |
MK308539, JL706 |
| J. longifurca (T) |
roca |
La Coruña, Barrañán, 22/I/2011, I. Bárbara, R. Barreiro, C. Pardo y V. Peña s.n. leg. (SANT-Algae 27780) |
MK308535, CPVP369 |
| J. rubens (A) |
maerl |
Pontevedra, Punta Barbafeita, 23/XI/2010, I. Bárbara, R. Barreiro, C. Pardo y V. Peña s.n. leg. (SANT-Algae 27567, 32489) |
MK308532, JL704 |
| J. rubens (T) |
roca (epífita) |
La Coruña, playa de Riazor. 30/III/2017, J. Lugilde s.n. leg. (SANT-Algae 32488) |
MK308536, JL701 |
| J. rubens (T) |
roca (epífita) |
Lugo, Peinzás, 09/II/2011, I. Bárbara, R. Barreiro, C. Pardo y V. Peña s.n. leg. (SANT-Algae 27772) |
MK308538, CPVP384 |
| J. rubens (T) |
roca (epífita) |
La Coruña, playa das Fontes, Covas, Cabo Prior, 19/V/2012, I. Bárbara, R. Barreiro, C. Pardo y V. Peña s.n. leg. (SANT-Algae
32513) |
MK308537, VPF00439 |
| Secuencias adicionales de GenBank y haplotipos correspondientes |
| |
|
Código de la secuencia en GenBank |
Origen |
| Corallinales sp. |
|
FJ361388 |
Nueva Zelanda |
| Corallinales sp. |
|
FJ361398 |
Nueva Zelanda |
| Corallinales sp. |
|
FJ361546, FJ361406 |
Nueva Zelanda |
| Corallinales sp. |
|
FJ361405 |
Nueva Zelanda |
| Corallinales sp. |
|
FJ361465 |
Nueva Zelanda |
| Corallinales sp. |
|
FJ361562, FJ361470 |
Nueva Zelanda |
| Corallinales sp. |
|
FJ361656, FJ361653 |
Nueva Zelanda |
| Corallinales sp. |
|
FJ361740 |
Nueva Zelanda |
| J. micrarthrodia |
|
MH017051, MH017052 |
Australia |
| J. micrarthrodia |
|
MH017053 |
Australia |
| J. rosea |
|
EF628245, FJ361425 |
Nueva Zelanda |
| J. rosea |
|
EF628244 |
Nueva Zelanda |
| J. rosea |
|
FJ361713 |
Nueva Zelanda |
| J. rubens |
|
KM044019 |
Brasil |
| J. sagittata |
|
DQ168009 |
Nueva Zelanda |
| J. sagittata |
|
JQ422232 |
Australia |
| J. sagittata |
|
KP224288 |
Australia |
| J. sagittata |
|
DQ167881, FJ361571 |
Nueva Zelanda |
| Jania sp. |
|
DQ167886 |
Nueva Zelanda |
| Jania sp. |
|
DQ167885, FJ361631, FJ361660, FJ361756, FJ361752, FJ361712, FJ361686 |
Nueva Zelanda |
| Jania sp. |
|
DQ167913 |
Nueva Zelanda |
| Jania sp. |
|
DQ168021 |
Nueva Zelanda |
| Jania sp. |
|
FJ361501 |
Nueva Zelanda |
| J. sphaeroramosa |
|
MH017054 |
Nueva Zelanda |
| J. sphaeroramosa |
|
MH017055 |
Nueva Zelanda |
| J. sphaeroramosa |
|
MH017056, MH017057, MH017062, MH017063, MH017064, MH026110, MH026111, FJ361568, FJ755792, DQ168020 |
Nueva Zelanda |
| J. sphaeroramosa |
|
MH017058 |
Nueva Zelanda |
| J. sphaeroramosa |
|
MH017059 |
Nueva Zelanda |
| J. sphaeroramosa |
|
MH017060 |
Nueva Zelanda |
| J. sphaeroramosa |
|
MH017061 |
Nueva Zelanda |
| “Uncultured Corallinales” |
|
GQ917441 |
España |
| “Uncultured Corallinales” |
|
GQ917712 |
Francia |
| “Uncultured Corallinales” |
|
GQ917713 |
Francia |
| “Uncultured Corallinales” |
|
GQ917731 |
Vanuatu |
| “Uncultured Corallinales” |
|
GQ917750 |
Vanuatu |
| “Uncultured Corallinales” |
|
GQ917832 |
Vanuatu |
| “Uncultured Corallinales” |
|
GQ918123 |
Polinesia francesa |
| Corallina officinalis |
|
GQ917709 |
Francia |
RESULTADOSTOP
Análisis filogenéticoTOP
Del total de ejemplares seleccionados para el estudio molecular —quince en total—, solo se obtuvieron secuencias de calidad para nueve (tabla 1): tres previamente identificados con J. longifurca, con morfología atípica y procedentes de fondos de maerl, dos identificados con J. longifurca y procedentes de roca, uno identificado con J. rubens y procedente de fondo de maerl y, por último, tres identificados con J. rubens y procedentes de roca. Los análisis filogenéticos del alineamiento de psbA —44 secuencias de haplotipos, 729 pares de bases con 174 sitios variables— emplazaron esta morfología atípica de J. longifurca en un clado con mucho apoyo estadístico y junto a los ejemplares con morfología típica y a dos secuencias de GenBank llamadas “Uncultured Corallinales” que proceden del Atlántico ibérico y el Mediterráneo francés (fig. 1, tabla 1). En este mismo clado también aparecieron incluidos varios haplotipos que corresponden a secuencias de una especie de Jania de Nueva Zelanda recientemente analizadas en Twist & al. (2018). Asimismo, fueron notables dos clados separados de J. rubens que contenían material recolectado en Galicia y de Brasil, respectivamente.
|
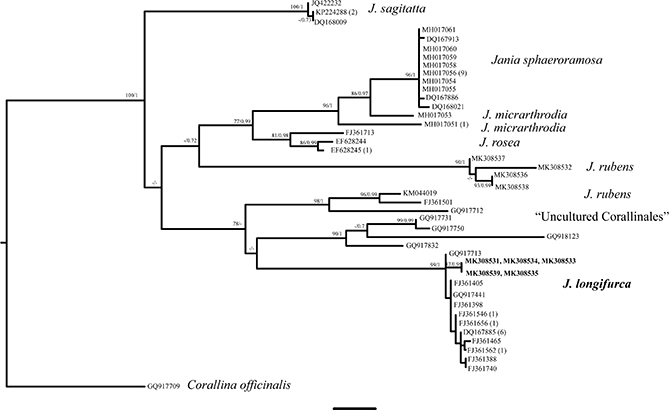 Fig. 1. Árbol filogenético inferido con análisis de máxima verosimilitud e inferencia bayesiana de las secuencias haplotipo de psbA de J. longifurca Zanardini y de secuencias públicas disponibles para este género. [Se muestran valores bootstrap para ML > 60% y probabilidad posterior > 0,60 de inferencia bayesiana; escala: 0,01 substituciones.] Fig. 1. Árbol filogenético inferido con análisis de máxima verosimilitud e inferencia bayesiana de las secuencias haplotipo de psbA de J. longifurca Zanardini y de secuencias públicas disponibles para este género. [Se muestran valores bootstrap para ML > 60% y probabilidad posterior > 0,60 de inferencia bayesiana; escala: 0,01 substituciones.]
|
|
Análisis morfológico de Jania longifurcaTOP
Los ejemplares atípicos son abundantes en fondos de maerl (fig. 2b-l) y presentan un talo de pequeño tamaño (fig. 2b) y morfología irregular (fig. 2a). Este talo atípico mide 0,3–3,5(5,2) mm de altura y es frágil, en ocasiones cespitoso, y está fijado al substrato por pequeños discos de 0,2–0,8 mm, de los que parten ejes decumbentes (fig. 2c). La ramificación es dicotómica e irregular (fig. 2b, k), en ocasiones decusada y divaricada (fig. 2g), con 1–2(6) intergenículos entre cada ramificación. Los ángulos de ramificación son variables, generalmente agudos entre 30–80º (fig. 2h), aunque en ocasiones son muy abiertos, en más de 120º (fig. 2i). En algunos ejemplares, los ápices se atenúan y tienen una última dicotomía generalmente aguda (fig. 2j). Los intergenículos son cilíndricos y delgados —100–550 μm de longitud y 70–180 μm de diámetro— y no tienen lóbulos distales, o bien estos se presentan de manera muy ocasional. La relación longitud/diámetro de los intergenículos es de 2,5. El número de capas medulares de los intergenículos es 3–7 (fig. 2l). Los genículos miden 30–70 μm de longitud y 40–60 μm de diámetro y están compuestos por una fila única de células, cuyo tamaño solapa con el de las células medulares de los intergenículos —25–70 × 8–15 μm—. El material estudiado presentó gran capacidad para la refijación a diversos substratos y materiales, debido a los numerosos discos secundarios basales o laterales (fig. 2f), los intergenículos adheridos a diferentes substratos, como piedras, cascajo o maerl, incluso por su parte apical (fig. 2d), y las pequeñas estructuras calcificadas o engrosamientos que sirven para la conexión de intergenículos a otros intergenículos del mismo talo o de otro (fig. 2f). No se observaron conceptáculos en ninguno de los ejemplares.
|
 Fig. 2. Variabilidad morfológica de Jania longifurca Zanardini en el maerl: a, b, hábito; c, epífita sobre Phymatolithon lusitanicum V.Peña con los ejes decumbentes; d, fragmento apical refijado sobre cascajo; e, ejes partiendo de un disco secundario; f, eje con un engrosamiento calcificado —punta de flecha— y un disco secundario —flecha—; g, talo dicotómico decusado, con ramas divaricadas; h, dicotomías con ángulos 30-80º —flechas—; i, rama superior dividida en ángulo de más de 120º; j, ápices atenuados —flechas— con ramificación dicotómica en ángulo agudo; k, intergenículos con ramificación dicotómica irregular; l, intergenículos descalcificados, con 5–6 capas de células medulares —microscopio óptico—. [Escalas: a, 1,5 cm; b, 1 cm; c, e, f-j, 1 mm; d, 0,5 mm; k, 0,5 cm; l, 50 μm.] Fig. 2. Variabilidad morfológica de Jania longifurca Zanardini en el maerl: a, b, hábito; c, epífita sobre Phymatolithon lusitanicum V.Peña con los ejes decumbentes; d, fragmento apical refijado sobre cascajo; e, ejes partiendo de un disco secundario; f, eje con un engrosamiento calcificado —punta de flecha— y un disco secundario —flecha—; g, talo dicotómico decusado, con ramas divaricadas; h, dicotomías con ángulos 30-80º —flechas—; i, rama superior dividida en ángulo de más de 120º; j, ápices atenuados —flechas— con ramificación dicotómica en ángulo agudo; k, intergenículos con ramificación dicotómica irregular; l, intergenículos descalcificados, con 5–6 capas de células medulares —microscopio óptico—. [Escalas: a, 1,5 cm; b, 1 cm; c, e, f-j, 1 mm; d, 0,5 mm; k, 0,5 cm; l, 50 μm.]
|
|
La morfología típica de J. longifurca es habitual en substrato rocoso (fig. 3a), aunque también aparece en fondos de maerl (fig. 2a). Esta morfología se caracteriza por talos robustos hasta de 12 cm, fijados al sustrato por una base costrosa de 20–27 mm de diámetro, de la que parten ejes erectos cilíndricos que se ramifican dicotómicamente (fig. 3b-d) con un ángulo de ramificación agudo de 25–45º. El material estudiado presenta intergenículos de 120–950 μm de longitud y
115–370 μm de diámetro y células de los genículos generalmente iguales o mayores —40–130 μm— que las células medulares de los intergenículos —20–110 μm—. Asimismo, observamos estructuras semejantes a la morfología atípica, pero de forma escasa, a saber: intergenículos delgados —de menos de 180 μm, fig. 3e-f), ramas divaricadas en la parte basal (fig. 3g) y algunas estructuras de refijación, tales como discos secundarios (fig. 3h) e intergenículos unidos por engrosamientos calcificados (fig. 3i).
|
 Fig. 3. Variabilidad morfológica de Jania longifurca Zanardini en roca: a, hábito; b, base costrosa, de la que parten numerosos ejes erguidos; c, d, intergenículos superiores robustos y con ramificación dicotómica regular; e, f, diámetro variable en ejes principales —flechas— y ramas delgadas —puntas de flecha—; g, ejes y ramas parcialmente divaricadas; h, disco secundario; i, ramas con engrosamientos calcificados. [Escalas: a, 1 cm; b, 2 mm; c, d, g-i, 1mm; e, f, 0,7 mm.] Fig. 3. Variabilidad morfológica de Jania longifurca Zanardini en roca: a, hábito; b, base costrosa, de la que parten numerosos ejes erguidos; c, d, intergenículos superiores robustos y con ramificación dicotómica regular; e, f, diámetro variable en ejes principales —flechas— y ramas delgadas —puntas de flecha—; g, ejes y ramas parcialmente divaricadas; h, disco secundario; i, ramas con engrosamientos calcificados. [Escalas: a, 1 cm; b, 2 mm; c, d, g-i, 1mm; e, f, 0,7 mm.]
|
|
DISCUSIÓN Y CONCLUSIONESTOP
Los resultados de los análisis filogenéticos han indicado que los ejemplares de Jania, dominantes en fondos de maerl y cuya morfología difiere de la típica de J. longifurca, no muestran diferencias genéticas con talos de esta especie que proceden de hábitats rocosos. Nuestros resultados han confirmado, por tanto, que el género Jania en Galicia está representado por cinco taxones: J. longifurca, J. rubens, J. rubens var. corniculata, J. squamata y J. virgata. El material gallego de J. longifurca se corresponde, además, con otro que procede de localidades del Atlántico ibérico y el Mediterráneo francés y que, hasta ahora, no estaba identificado, por lo que el presente trabajo aporta secuencias de ADN de J. longifurca que, también hasta ahora, faltaban en GenBank. Por otra parte, hemos detectado una cierta relación filogenética entre este material europeo y ejemplares recolectados en Nueva Zelanda de donde aparentemente J. longifurca no ha sido citada, sino J. rosea (Lam.) Decne., J. sagittata (J.V.Lamour.) Blainv., J. verrucosa J.V.Lamour., Jania sp. ‘fine’ y J. sphaeroramosa Twist, J.E.Sutherland & W.A.Nelson (Farr & al. 2009; Twist & al. 2018). Presumiblemente, futuros estudios filogenéticos, que dispongan de material tipo de J. longifurca y de estas especies, permitirán resolver su sistemática.
El estudio integrador de ambas morfologías ha demostrado la gran variación morfológica de J. longifurca con respecto al ambiente. Así, en fondos de maerl dominan los talos de pequeño tamaño y ejes decumbentes, sin base costrosa prominente, ramificación dicotómica irregular, en ocasiones decusada y divaricada, e intergenículos delgados y frágiles. Los talos que crecen en roca —y, ocasionalmente, en fondos de maerl— son de mayor tamaño y tienen una base costrosa muy evidente, ramificación dicotómica regular, intergenículos anchos y robustos y escasa presencia de discos secundarios, engrosamientos calcificados o ramas delgadas y divaricadas. Esta variabilidad infraespecífica, ahora confirmada en J. longifurca, se había observado también en J. rubens y J. adhaerens (Hamel & Lemoine 1952; Dawson 1953; Ardré 1970; Cabioch 1972; Irvine & Chamberlain 1994). Por otra parte, si bien en los talos típicos de roca estudiados, el tamaño de las células de los genículos es ligeramente más grande que el de las células medulares de intergenículos, en J. longifurca de fondos de maerl los tamaños de ambos tipos de células son similares. Estas observaciones contrastan con la información contenida en la literatura, donde se indica que las células de los genículos son comparativamente más largas que las células medulares de intergenículos (Hamel & Lemoine 1952; Afonso-Carrillo & Sansón 1999). Esta discrepancia en una característica morfológica asociada a J. longifurca, hace necesario plantear futuros estudios filogenéticos para comprobar su consistencia.
Estos caracteres diferenciales en la morfología atípica de J. longifurca se mencionan en la bibliografía para especies meridionales como J. adhaerens, J. capillacea y J. pumila (tabla 2) que, además, presentan una amplia distribución (Guiry & Guiry 2019). Sabidos nuestros resultados para J. longifurca y la gran variabilidad morfológica en este género, es posible que este caso de variabilidad infraespecífica suceda en otros territorios. Si tenemos en cuenta que algunos de estos caracteres morfológicos tienen caracter diagnóstico, recomendamos abordar nuevos estudios integradores en otras regiones para confirmar su correcta aplicación. Los talos de J. longifurca que dominan en los fondos de maerl tienen una gran capacidad para refijarse a diversos substratos y materiales; esta se manifiesta con el desarrollo de uniones al propio talo, al maerl o a otro tipo de substrato por las partes apicales, engrosamientos calcificados y numerosos discos secundarios. Estos últimos han sido mencionados para J. rubens por Hamel & Lemoine (1952), pero sin definir una posible función. De esta forma, J. longifurca en los fondos de maerl jugaría una estrategia parecida a la de las especies Gelidiella calcicola Maggs & Guiry y Gelidium maggsiae Rico & Guiry (Bárbara & al. 2004), desarrollando varios puntos de refijación al substrato y formando matas de ramas, maerl y cascajo que se unen al talo y forman un entramado estable, pero móvil, en el que la polaridad sería cambiante. Sin embargo, en substratos rocosos más estables, la morfología dominante es más robusta y tiene un patrón de ramificación más constante. Los ejemplares de J. longifurca que dominan en fondos de maerl carecen de estructuras reproductoras, lo que sugiere una estrategia de propagación por fragmentación, similar a la descrita para las especies formadoras de maerl en Galicia —Phymatolithon calcareum (Pallas) W.H.Adey & D.L.McKibbin, Phymatolithon lusitanicum V.Peña y Lithothamnion corallioides (P.Crouan & H.Crouan) P.Crouan & H.Crouan (Peña & al. 2015b)—. Un similar proceso de propagación vegetativa fue comentado por Cabioch (1972) en J. rubens y otras especies geniculadas.
Tabla 2. Caracteres morfológicos de las especies de Jania J.V.Lamour. en Galicia y regiones adyacentes. [En negrita, los caracteres diagnósticos. T, morfología típica; A, morfología atípica. Fijación: Cos, base costrosa; Riz, rizoides; Sec, con discos secundarios. Intergenículos: Cil, cilíndricos; Com, comprimidos; Tra, trapezoidales. Ramificación (primaria/secundaria): Dc, dicotómica; Dc-t, di-tricotómica; Dec, decusada; Div, divaricada; Op, opuesta; Pin, pinnada; Var, variable. Referencias: 1, Lugilde & al. (2017); 2, Lamouroux (1816); 3, Montagne (1846); 4, Areschoug (1852); 5, Harvey (1853); 6, Yendo (1902); 7, Børgesen (1917); 8, Setchell & Gardner (1930); 9, Taylor (1945); 10, Dawson (1953); 11, Villena-Balsa & al. (1987); 12, Afonso-Carrillo & Sansón (1999); 13, Enríquez & al. (2009); 14, Klein & Verlaque (2009); 15, Rodríguez-Prieto & al. (2013); 16, Mateo-Cid & al. (2013); 17, Cormaci & al. (2017).]
| |
J. longifurca (A) |
J. longifurca (T) |
J. adhaerens |
J. capillacea |
J. pumila |
J. rubens |
J. rubens var. corniculata |
J. squamata |
J. virgata |
| Fuente |
presente estudio |
1 y presente estudio |
2–4, 6-9 y 12–17 |
5, 9, 10, 12, 16 y 17 |
2, 4, 7, 11 y 12 |
1 y presente estudio |
1 y presente estudio |
1 |
1 |
| Tamaño (cm) |
0,3–3,5(5,2) |
4–12 |
0,3–3,5 |
2–4 |
<1(0,6) |
2–8 |
2–8 |
12 |
2,5–6 |
| Fijación |
Cos (Sec) |
Cos (Sec, Riz) |
Cos (Sec) |
Cos (Sec) |
Cos (Sec) |
Cos (Riz) |
Cos (Riz) |
Riz |
Cos (Riz) |
| Diámetro de la base costrosa (mm) |
0,2–0,8 |
20-27 |
— |
— |
0,4–0,7(0,9) |
1–5 |
1–5 |
— |
2–5 |
| Diámetro de los rizoides (μm) |
— |
200-300 |
— |
— |
— |
120–200 |
100–200 |
200–1500 |
50–200 |
| Ejes decumbentes |
sí |
no |
sí |
sí |
sí |
sí |
sí |
no |
no |
| Ramificación primaria |
Dc, Irr |
Dc |
Dc, Irr |
Dc, Irr |
Dc |
Dc |
Dc |
Dc |
Dc-t/Var |
| Ramificación secundaria |
Dc, Irr, Dec, Div |
Dc, Div |
Dc, Irr, Dec, Div |
Dc, Irr, Dec, Div |
Dc, Dec |
Dc |
Dc |
Pin/Op |
Pin/Op/Var |
| Ángulo de ramificación |
30–80º(>120º) |
25–45º- |
30–75º. |
45–90º |
<45º |
10-45º |
20–90º |
20º |
20–45–100º |
| Número de intergenículos entre ramificaciones principales |
1–2(6) |
1–2 |
— |
— |
(1)2–5(9) |
1–2 |
1–6 |
1–6 |
1–6 |
| Intergenículos: morfología |
Cil |
Cil/Com |
Cil |
Cil |
Cil/Com/Tra |
Cil |
Tra |
Tra/Com |
Cil |
| Intergenículos: longitud (μm) |
100–550 |
120–950 |
400–600 |
— |
200–800 |
190–495(700) |
220–750 |
115–500(1100) |
150–865 |
| Intergenículos: diámetro (μm) |
70–180 |
115–370 |
100–200 |
50–110(150) |
(60)120–240 |
85–200(300) |
150-400 |
125–340(865) |
90–275 |
| Intergenículos: longitud (μm)/diámetro (μm) (base y ápice) |
2–3/2–3 |
1–4/6–9 |
—/10 |
4–6(10) |
2,5/— |
2–3/5–6 |
3–4/6–7 |
1–2/1–3 |
1,5–4/4–8 |
| Intergenículos con lóbulos distales |
no/muy ocasional |
no/muy ocasional |
no/muy ocasional |
no |
no/muy ocasional |
no/muy ocasional |
numerosos |
ocasional |
ocasional |
| Intergenículos: modificación del último intergenículo |
atenuado |
engrosado |
atenuado |
atenuado |
atenuado |
engrosado |
engrosado |
atenuado |
atenuado |
| Intergenículos: número de capas medulares |
3–7 |
4–9 |
— |
— |
— |
3–7 |
4–7 |
(4)6–9 |
4–6 |
| Intergenículos: longitud (μm)/diámetro (μm) de las células medulares |
25–70/8–15 |
20–110/— |
50–90/7–11 |
60–75(85)/7–12 |
— |
40–80/— |
75–150/— |
40–125(140)/— |
10–35/— |
| Genículos: diámetro (μm) |
40–60 |
50–130 |
(85)105–125(140) |
— |
— |
10–70 |
15–90 |
70–160(200) |
40–80 |
| Genículos: longitud (μm) |
30–70 |
40–130 |
— |
65–100(125) |
— |
20-60 |
110-180 |
60–180 |
25–100 |
| Conceptáculos: posición |
— |
intercalar/terminal |
intercalar/terminal |
terminal |
intercalar/terminal |
intercalar/terminal |
intercalar/terminal |
intercalar/terminal |
— |
| Conceptáculos con cornículos |
— |
2 |
— |
2–3 |
2–4 |
2–3 |
2–3 |
0–2 |
— |
| Conceptáculos de espermatocistes: longitud (μm)/diámetro (μm) |
— |
200–550/200–400 |
—/120–140 |
— |
250/140 |
130–400/75–325 |
100-425/75-250 |
300–600/200–400 |
— |
| Conceptáculos de tetrasporocistes: longitud (μm)/diámetro (μm) |
— |
300–1000/250–400 |
250–300/150–200 |
300–340/240–300 |
250/— |
300–600/175–350 |
300–600/150–400 |
300–1000/300–600 |
— |
| Tetrasporocistes: longitud (μm)/diámetro (μm) |
— |
70-145/15–55 |
40–45/120–130 |
— |
— |
75–120/40–70 |
90–160/30–70 |
90–130/25–50 |
— |
| Conceptáculos de carposporocistes: longitud (μm)/diámetro (μm) |
— |
200–650/150–350 |
— |
— |
(180)210–315(345)/— |
200–500/190–400 |
250–500/160–375 |
200–550/200–400 |
— |
| Carposporocistes: longitud (μm)/diámetro (μm) |
— |
100–200/20–70 |
— |
— |
— |
100–180/15–50 |
80–200/15–50 |
100–190/15–70 |
— |
| Hábitat |
epífito —maerl, cascajo, Jania spp.—, epilítico |
epífito —Lithophyllum spp.—, epilítico, epizoico |
epífito |
epífito, epilítico, epizoico |
epífito |
epífito, epilítico |
epífito, epilítico |
epífito, epilítico, epizoico |
epífito —Cladostephus spongiosum (Hud.) C.Agardh |
AGRADECIMIENTOSTOP
A la Xunta de Galicia —GPC2015/025—. V. Peña agradece el apoyo de la Universidade da Coruña —Contrato-Programa Campus Industrial—. Agradecemos a C. Pardo la facilitación de material molecular y a D. García San León —herbario de Santiago de Compostela, SANT— por el acceso al material de herbario. Agradecemos igualmente al revisor anónimo y al editor asociado por sus comentarios y sugerencias.
REFERENCIASTOP
| ○ |
Afonso-Carrillo J. & Sansón M. 1999. Algas, hongos y fanerógamas marinas de las Islas Canarias. Clave analítica. Servicio de Publicaciones Universidad de La Laguna, San Cristóbal de La Laguna. |
| ○ |
Ardré F. 1970. Contribution a l’etude des algues marines du Portugal. Portugal. I. La flore. Portugaliae Acta Biologica, Série B, Sistemática, Ecologia, Biogeografia e Paleontologia 10: 137–555. |
| ○ |
Areschoug J.E. 1852. Corallinaceae. In Agardh J.G., Species, Genera et Ordines Algarum, vol. 2 (2): 1–508. Gleerup, Lund. |
| ○ |
Bárbara I., Cremades J. & Veiga A.J. 2004. Floristic study of a maërl & gravel subtidal bed in the Arousa ría (Galicia, Spain).
Botanica Complutensis 28: 35–46. |
| ○ |
Bittner L. 2009. Phylogénie des Corallinales (Rhodophyta) et analyse de leur diversité génétique dans le Pacifique Sud. Ph.D. dissertation, Muséum National d’Histoire Naturelle, Paris. |
| ○ |
Børgesen F. 1917. The marine algae of the Danish West Indies. Part 3. Rhodophyceae 3. Dansk Botanisk Arkiv 3: 145–240. |
| ○ |
Cabioch 1972. Étude sur les Corallinacées. II. La morphogenese: conséquences systématiques et phylogénétiques. Cahiers de Biologie Marine 13: 137–288. |
| ○ |
Cormaci M., Furnari G. & Alongi G. 2017. Flora marina bentónica del Mediterraneo: Rhodophyta (Rhodymeniophycidae escluse). Bollettino delle sedute della Accademia gioenia di scienze naturali in Catania 50 (380): 1–391. |
| ○ |
Cremades J., Bárbara I. & Veiga A.J. 1997. Amphiroa van-bosseae (Corallinales, Rhodophyta) on European Atlantic coasts. Cryptogamie, Algologie 18 (1): 11–17. |
| ○ |
Darriba D., Taboada G.L., Doallo R. & Posada D. 2012. jModelTest 2: more models, new heuristics and parallel computing. Nature Methods 9: 772. https://doi.org/10.1038/nmeth.2109 |
| ○ |
Dawson E.Y. 1953. Marine red algae of Pacific Mexico. Part 1. Bangiales to Corallinaceae subf. Corallinoideae. Allan Hancock Pacific Expeditions 17: 1–239. |
| ○ |
Enríquez S.A., Ávila E. & Carballo J.L. 2009. Phenotypic plasticity induced in transplant experiments in a mutualistic association between the red alga Jania adhaerens (Rhodophyta, Corallinales) and the sponge Haliclona caerulea (Porifera: Haplosclerida): morphological responses of the alga. Journal of Phycology 45: 81–90. https://doi.org/10.1111/j.1529-8817.2008.00640.x |
| ○ |
Farr T., Broom J., Hart D., Neill K. & Nelson W. 2009. Common Coralline algae of Northern New Zealand. Science Communication [NIWA Information Series n.º 70], Wellington. |
| ○ |
Guiry M.D. & Guiry G.M. 2019. AlgaeBase. World-wide electronic publication. National University of Ireland, Galway. Página web: http://www.algaebase.org [consultada: 1/I/2019]. |
| ○ |
Guoy M., Guindon S. & Gascuel O. 2010. SeaView Version 4: a multiplatform graphical user interface for sequence alignment and phylogenetic tree building. Molecular Biology and Evolution 27: 221–224. https://doi.org/10.1093/molbev/msp259 |
| ○ |
Hamel G. & Lemoine P. 1952. Corallinacées de France et d’Afrique du Nord. Archives du Museum National d’Histoire Naturelle ser. 7, 1: 17–136. |
| ○ |
Harvey W.H. 1853. Nereis boreali-americana; or contributions towards a history of the marine algae of the Atlantic and Pacific coasts of North America. Part II. Rhodospermeae. Smithsonian Contributions to Knowledge 5 (5): i–ii, 1–258. |
| ○ |
Irvine M.L. & Chamberlain M.Y. 1994. Seaweeds of the British Isles, vol. 1 (2B). The Natural History Museum, Londres. |
| ○ |
Kim J.H., Guiry M.D., Oak J.H., Choi D.S., Kang S.H., Chung H. & Choi H.G. 2007. Phylogenetic relationships within the tribe
Janieae (Corallinales, Rhodophyta) based on molecular and morphological data: a reappraisal of Jania. Journal of Phycology 43: 1310–1319. https://doi.org/10.1111/j.1529-8817.2007.00410.x |
| ○ |
Klein J.C. & Verlaque M. 2009. Macroalgal assemblages of distubed coastal detritic bottoms subject to invasive species. Estuarine, Coastal and Shelf Science 82: 461–468. https://doi.org/10.1016/j.ecss.2009.02.003 |
| ○ |
Lugilde J., Peña V. & Bárbara I. 2016. El orden Corallinales sensu lato (Rhodophyta) en el Atlántico ibérico: estado actual de su conocimiento. Anales del Jardín Botánico de Madrid 73 (2): e038. https://doi.org/10.3989/ajbm.2424 |
| ○ |
Lugilde J., Peña V. & Bárbara I. 2017. Morfología y distribución de Jania virgata (Corallinales, Rhodophyta) y revisión del género Jania s.l. en Galicia. Nova Acta Científica Compostelana (Bioloxía) 24: 105–116. |
| ○ |
Mateo-Cid L.E., Mendoza-González A.C., Aguilar-Rosas L.E. & Aguilar-Rosas R. 2013. Occurrence and distribution of the genus Jania J.V. Lamouroux (Corallinales, Rhodophyta) in the Pacific coast of Baja California and Gulf of California, Mexico. American Journal of Plant Sciences 4: 1–13. https://doi.org/10.4236/ajps.2013.412A2001 |
| ○ |
Montagne J.F.C. 1846. Flore d’Algérie. Ordo 1. Phyceae Fries. In Durieu De Maisonneuve M.C. & al. (eds), Exploration scientifique de l’Algérie pendant les années 1840, 1841, 1842, 1: 1–197. https://doi.org/10.5962/bhl.title.112444 |
| ○ |
Peña V., Bárbara I., Grall J., Maggs C.A. & Hall-Spencer J.M. 2014. The diversity of seaweeds on maerl in the NE Atlantic.
Marine Biodiversity 44 (4): 533–551. https://doi.org/10.1007/s12526-014-0214-7 |
| ○ |
Peña V., De Clerck O., Bárbara I., Barreiro R., Afonso-Carrillo J., Ballesteros E. & Le Gall L. 2015a. An integrative systematic approach to species diversity and distribution in the genus Mesophyllum (Corallinales, Rhodophyta) in Atlantic and Mediterranean Europe. European Journal of Phycology 50: 20–36. https://doi.org/10.1080/09670262.2014.981294 |
| ○ |
Peña V., Pardo C., López L., Carro B., Hernández-Kantún J., Adey W.H., Bárbara I., Barreiro R. & Le Gall L. 2015b. Phymatolithon lusitanicum sp. nov. (Hapalidiales, Rhodophyta): the third most abundant maerl-forming species in the Atlantic Iberian Peninsula. Cryptogamie, Algologie 36 (4): 429–459. https://doi.org/10.7872/crya/v36.iss4.2015.429 |
| ○ |
Ratnasingham S. & Hebert D.P. 2007. BOLD: The Barcode of Life Data System (www.barcodinglife.org). Molecular Ecology Notes 7 (3): 355–364. https://doi.org/10.1111/j.1471-8286.2007.01678.x |
| ○ |
Rodríguez-Prieto C., Ballesteros E., Boisset F. & Afonso-Carrillo J. 2013. Guía de las macroalgas y fanerógamas marinas del Mediterráneo occidental. Ediciones Omega S.A., Barcelona. |
| ○ |
Ronquist F. & Huelsenbeck J.P. 2003. MRBAYES 3: Bayesian phylogenetic inference under mixed models. Bioinformatics 19: 1572–1574. https://doi.org/10.1093/bioinformatics/btg180 |
| ○ |
Setchell A.W. & Gardner L.N. 1930. Marine algae of the Revillagigedo Islands expedition in 1925. Proceedings of the California Academy of Sciences 4 (19): 109–215. |
| ○ |
Tamura K., Stecher G., Peterson D., Filipski A. & Kumar S. 2013. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0.
Molecular Biology and Evolution 30: 2725–2729. https://doi.org/10.1093/molbev/mst197 |
| ○ |
Taylor W.R. 1945. Pacific marine algae of the Allan Hancock Expeditions to the Galapagos Islands. Allan Hancock Pacific Expeditions 12: i–iv, 1–528. |
| ○ |
Twist A.B., Sutherland E.J. & Nelson A.W. 2018. Epiphytic Jania in New Zealand: Jania sphaeroramosa sp. nov. (Corallinales, Rhodophyta). Phytotaxa 357 (1): 30–40. https://doi.org/10.11646/phytotaxa.357.1.3 |
| ○ |
Villena-Balsa M., Afonso-Carrillo J. & Wildpret de la Torre W. 1987. Morfología, estructura y reproducción de una especie epífita del género Jania (Corallinaceae, Rhodophyta) de las Islas Canarias. Vieraea 17: 19–42. |
| ○ |
Woelkerling W.J., Harvey A.S. & Reviers B. 2015a. Jania verrucosa and Jania crassa (Rhodophyta: Corallinaceae): typification, nomenclature and taxonomic implications. Taxon 64 (1): 137–146. https://doi.org/10.12705/641.1 |
| ○ |
Woelkerling W.J., Harvey A.S. & Reviers B. 2015b. (2340). Proposal to reject the name Jania verrucosa (Rhodophyta: Corallinaceae). Taxon 64 (1): 167. https://doi.org/10.12705/641.6 |
| ○ |
Woelkerling W.J., Harvey A.S. & Reviers B. 2015c. Jania pedunculata (Rhodophyta, Corallinaceae): typification, nomenclature, and taxonomic status relative to J. crassa, J. verrucosa sensu Johansen & Womersley, and J. ungulata. Taxon 64 (6): 1280–1293. https://doi.org/10.12705/646.10 |
| ○ |
Yendo K. 1902. Corallinae verae japonicae. Journal of the College of Science, Tokyo Imperial University 16 (3): 1–36. |
| ○ |
Yendo K. 1905. A revised list of Corallinae. Journal of the College of Science, Tokyo Imperial University 20 (12): 1–46. |
Fig. 1. Árbol filogenético inferido con análisis de máxima verosimilitud e inferencia bayesiana de las secuencias haplotipo de psbA de J. longifurca Zanardini y de secuencias públicas disponibles para este género. [Se muestran valores bootstrap para ML > 60% y probabilidad posterior > 0,60 de inferencia bayesiana; escala: 0,01 substituciones.]