Estructura, biogénesis y dependencia nutritiva de los esclerocios de Paxillus ammoniavirescens (Boletales, Paxillaceae)
Elena Fernández-Miranda Cagigal* & Abelardo Casares Sánchez
Facultad de Biología, Dpto. de Biología de Organismos y Sistemas, Área de Fisiología Vegetal, Universidad de Oviedo, c/ Catedrático Rodrigo Uría s.n., 33006 Oviedo, España; cagigal_11@hotmail.com
* Autor para la correspondencia
| |
Resumen
Fernández-Miranda, E. & Casares, A. 2017. Estructura, biogénesis y dependencia nutritiva de los esclerocios de Paxillus ammoniavirescens (Boletales, Paxillaceae). Anales Jard. Bot. Madrid 74(1): e054.
El objetivo de este trabajo ha sido estudiar la estructura, composición y biogénesis de los esclerocios de Paxillus ammoniavirescens, así como su posible utilización como inóculo en la micorrización de abedul. Por medio de tinciones histoquímicas se ha observado un cambio de la composición y organización interna de estas estructuras durante su maduración. La formación del esclerocio se inicia con un agrupamiento de hifas que da lugar a una estructura con pseudoparénquima en la parte central; estos esclerocios inmaduros se desarrollan hasta que, en la madurez, se forma una corteza externa pseudoparenquimática de 6 o 7 capas de hifas y una médula en su interior. Las hifas de los esclerocios maduros presentan una gran cantidad de cuerpos proteicos, en contraste con escasos acúmulos lipídicos. La formación de esclerocios está influenciada por las características del medio de cultivo y la temperatura. El mayor número de esclerocios se obtuvo reduciendo la concentración del fosfato diamónico a 0,94 mM en el medio MMN y manteniendo los cultivos a 8 °C durante 2 semanas. Finalmente se ha demostrado que los esclerocios de esta especie pueden ser utilizados directamente como inóculo, tanto para generar micelio en los medios de cultivo como para micorrizar in vitro plantas de abedul.
Palabras clave: Fertilización con nitrógeno, histoquímica, inóculo fúngico, sustancias de reserva, temperatura.
|
| |
Abstract
Fernández-Miranda, E. & Casares, A. 2017. Structure, biogenesis and nutricional dependence of Paxillus ammoniavirescens sclerotia (Boletales, Paxillaceae). Anales Jard. Bot. Madrid 74(1): e054.
The objective of this work was to study the structure, composition, and biogenesis of Paxillus ammoniavirescens sclerotia, as well as their possible use as inoculum for birch mycorrhizae. By means of histochemical stains, a change of the composition and internal organization of these structures during their maturation was observed. The formation of sclerotia begins with a clustering of hyphae that gives rise to a structure with pseudoparenchyma in the central part; these immature sclerotia develop to form, at maturity, a pseudoparenchymatic outer cortex of 6 or 7 layers of hyphae around an inner medulla. The hyphae of mature sclerotia have a large number of protein bodies in contrast to scarce lipid accumulations. The formation of sclerotia is influenced by the characteristics of the culture medium and the temperature. The greatest number of sclerotia was obtained by reducing the concentration of the diammonium phosphate to 0.94 mM in the MMN medium, and maintaining the cultures at 8 °C for 2 weeks. Finally it was shown that the sclerotia of this species can be used directly as inoculum, both to generate mycelium in the culture media and to initiate mycorrhizae in birch plants in vitro.
Keywords: Mycorrhizal inoculum, histochemistry, nitrogen fertilization, reserve substances, temperature.
|
INTRODUCCIÓNTOP
Los esclerocios son unas estructuras de resistencia que sobreviven en condiciones desfavorables para el micelio (Willetts, 1971) y germinan produciendo micelio, esporas asexuales o esporocarpos productores de esporas sexuales (Coley-Smith & Cooke, 1971; Deacon, 2006). La capacidad de producción de estas estructuras se ha comprobado en muchos hongos saprófitos —v.gr., en Sclerotinia sclerotiorum (Lib.) De Bary, Rhizoctonia solani J.G. Kühn o Sclerotium rolfsii Sacc.—; sin embargo, en hongos ectomicorrícicos solo hay estudios en detalle para algunas especies como P. involutus (Batsch) Fr. o Pisolithus tinctorius (Mont.) E. Fisch (Peterson & al., 2004). En el caso de P. ammniovirescens Contu & Dessì, organismo pionero que se encuentra frecuentemente en zonas degradadas, se desconocía. Dado su potencial uso como inóculo, el presente trabajo se centra en el estudio de estas estructuras en P. ammniovirescens y su biogénesis para su posible aplicación en programas de micorrización controlada.
MATERIAL Y MÉTODOSTOP
Paxillus ammoniavirescens se aisló a partir de tejidos internos de cuerpos fructíferos recolectados bajo Betula celtiberica Rothm. & Vasc. (Fernández & al., 2008); su identificación se realizó mediante análisis filogenético (Fernández-Miranda, 2014). Definimos 2 estadios de desarrollo de esclerocios: inmaduros (Fig. 1a), de pequeño tamaño, blancos y cuyo tamaño aumenta; y maduros (Fig. 1b), con una corteza negra visible y cuyo tamaño no aumenta. Para observar la estructura exterior se utilizó una lupa Nikon modelo SMZ-U y, para estudiar su estructura interna, se realizaron cortes de 10 a 30 μm de espesor que se analizaron con un microscopio Nikon modelo Optiphot con sistema de contraste diferencial de Normarski. Los cortes se tiñeron con azul de algodón en lactoglicerol o con azul de toluidina durante 1 h, para posteriormente lavarlos con lactoglicerol. Se realizaron 50 mediciones de cada una de las capas que se detectaron en los esclerocios. En esclerocios maduros, para determinar la presencia de mucopolisácaridos ácidos, se utilizó la tinción de azul de alcián en ácido acético al 3%, a pH 2,5 (Lev & Spicer, 1964); los cortes se tiñeron durante 30 min y se montaron en lactoglicerol. Para la localización de lípidos se utilizó la tinción Sudan Black B en etanol al 70% (Pearse, 1968); las secciones se tiñeron durante 5 min en este colorante y se montaron posteriormente en lactoglicerol. Para la determinación de los acúmulos proteicos se utilizó la tinción de Fucsina ácida (Grenville & al., 1985) durante 10 min, seguido de 10 min de lavado en lactoglicerol.
|
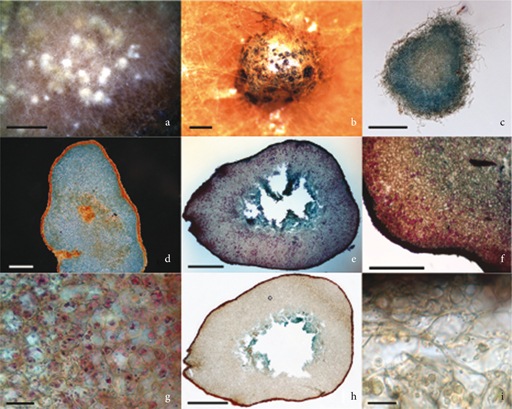 Fig. 1. Paxillus ammoniavirescens: a, esclerocios inmaduros; b, esclerocios maduros; c, esclerocio inmaduro teñido con azul de algodón; d, interior de esclerocio maduro teñido con azul de algodón; e, esclerocio maduro teñido con azul de toluidina que muestra todas las capas; f, detalle de las diferentes capas que se observan en un esclerocio; g, detalle los acúmulos proteicos; h, esclerocio maduro teñido con azul de alcián que muestra la presencia de mucopolisacáridos en las células del interior de la médula; i, pequeños acúmulos periféricos de lípidos teñidos mediante Sudan Black B. [Escala: a = 3 mm; b = 400 μm; c = 150 μm; d = 300 μm; e, g = 500 μm; f = 250 μm, h = 20 μm, i = 5 μm.] Fig. 1. Paxillus ammoniavirescens: a, esclerocios inmaduros; b, esclerocios maduros; c, esclerocio inmaduro teñido con azul de algodón; d, interior de esclerocio maduro teñido con azul de algodón; e, esclerocio maduro teñido con azul de toluidina que muestra todas las capas; f, detalle de las diferentes capas que se observan en un esclerocio; g, detalle los acúmulos proteicos; h, esclerocio maduro teñido con azul de alcián que muestra la presencia de mucopolisacáridos en las células del interior de la médula; i, pequeños acúmulos periféricos de lípidos teñidos mediante Sudan Black B. [Escala: a = 3 mm; b = 400 μm; c = 150 μm; d = 300 μm; e, g = 500 μm; f = 250 μm, h = 20 μm, i = 5 μm.]
|
|
En nuestro trabajo hemos realizado 2 ensayos para comprobar el efecto del fosfato diamónico —(NH4)2HPO4— del medio de cultivo y la temperatura en la producción de esclerocios. En el primero, se cultivó el hongo en el medio MMN (Harvey, 1991) con 3 concentraciones distintas de fosfato diamónico —1,89 mmol/l; 3,78 mmol/l (N+) y 0,94 mmol/l (N-)— y a 3 temperaturas —8, 10 y 23 ºC—. Para cada concentración de fosfato diamónico se emplearon 30 placas Petri inoculadas con un disco de micelio de 1 cm de diámetro y se mantuvieron a 23 ºC durante 10 semanas. Transcurrido este tiempo, y para comprobar si la disminución de la temperatura incrementa la producción de esclerocios, se colocaron 10 placas de cada concentración de nitrógeno a 10 ºC y a 8 ºC durante 2 semanas; las otras 10 placas restantes de cada concentración se mantuvieron como control a 23 ºC. En un segundo ensayo, se comprobó la capacidad de formación de esclerocios en los medios MS y 1/2 MS a 23 ºC y a 8 ºC. Se emplearon 20 réplicas en cada tratamiento. Los datos se analizaron con el paquete estadístico SPSS v. 15.0. El análisis de porcentajes se realizó empleando el z-test comparando 2 a 2 los diferentes tratamientos para un nivel de significación del 95% —p ≤ 0,05—, y aplicando el factor de corrección de Yates.
Por último, se comparó el crecimiento de micelio originado por 15 esclerocios con el originado a partir de 15 discos de micelio. Además, se estudió la capacidad de los esclerocios maduros de actuar como inóculo micorrízico, inoculando abedules procedentes de propagación in vitro: se colocaron directamente sobre la superficie del medio de cultivo 3 esclerocios maduros por tarro, para un total de 10 réplicas.
RESULTADOS Y DISCUSIÓNTOP
Durante el desarrollo de estas estructuras hemos podido comprobar que los esclerocios inmaduros, que están continuamente desarrollándose sobre el micelio, tienen un tamaño de 0,89 ± 0,04 mm de longitud y 0,57 ± 0,02 de anchura. Con frecuencia se forman juntos y pueden llegar a fusionarse. Tras 6-8 días de su aparición, algunos esclerocios continúan su desarrollo y alcanzan la madurez con un tamaño de 1,29 ± 0,05 mm de longitud y 1,20 ± 0,05 mm de anchura. Durante esta etapa final del desarrollo, aparece un exudado negro que puede cubrirlos completamente. En cuanto al proceso en sí, la tinción de azul de algodón muestra como los esclerocios inmaduros, constituidos por un agrupamiento de hifas, comienzan a formar un pseudoparénquima en la parte central (Fig. 1c), mientras que en esclerocios maduros se observan 2 capas diferenciadas (Fig. 1d). Una corteza externa de pseudoparénquima en estructura de red de 25,99 ± 0,61 μm, fuertemente pigmentada, sin espacios intercelulares obvios y con células elongadas, en la que no se observan ningún tipo de inclusión. En el interior se forma una médula, de tamaño variable según las dimensiones del esclerocio, de pseudoparénquima irregular, con células isodiamétricas y compactas, con numerosas inclusiones en las células periféricas, encontrándose algunas completamente vacías y de mayor tamaño en el centro. Dependiendo del estado de madurez, en el centro de la médula se pueden observar hifas fuertemente pigmentadas y, en la mayoría de los casos, degradadas, que vierten su contenido en el interior del esclerocio. La fase posterior a la degradación de estas células podría corresponder al estadio donde se observa un exudado negro sobre los esclerocios.
En esclerocios inmaduros, mediante la utilización del azul de toluidina, se observan en la médula hifas agrupadas, que constituyen un pseudoparénquima en el centro de la estructura. En esclerocios maduros se observa la diferenciación de 4 capas medulares. La capa más externa, situada inmediatamente después de la corteza, está formada por un pseudoparénquima irregular entrelazado —constituido por 2 o 3 capas de células—, en el que las hifas se conectan entre sí como en un puzle y en las que se comienzan a distinguir acúmulos de sustancias. Después, se encuentra una capa, de 0,26 ± 0,01 mm de anchura y pseudoparénquima irregular en la que se encuentran hifas metacromáticas rojas (Fig. 1f) debido a la presencia de polisacáridos ácidos; en estas hifas se observan claramente definidos acúmulos de reserva. Hacia el interior, aparece de nuevo un pseudoparénquima irregular entrelazado de 3 a 4 capas de células en las que comienzan a disminuir los acúmulos de reserva. Finalmente, el interior de la médula aparece degradado o formado por hifas que constituyen un pseudoparénquima irregular entrelazado, sin inclusiones (Fig. 1e). Tanto las células más internas de la médula como los intersticios de hifas inmediatamente anteriores presentan una coloración azul verdosa causada por la presencia de polifenoles, que salen desde las células internas hasta el exterior del esclerocio. La tinción de fucsina ácida muestra que la mayoría de las sustancias de reserva en la médula podrían ser acúmulos proteicos y se establece un gradiente de degradación desde el interior del esclerocio hasta la corteza (Fig. 1g). Mediante la tinción de azul de alcián, solo se detecta presencia de mucopolisacáridos en las células internas de la médula, en especial en las zonas degradadas (Fig. 1h). Por último, la tinción Sudan Black B evidencia pequeños gránulos de lípidos en la periferia de las células más cercanas a la corteza (Fig. 1i).
Los esclerocios maduros de P. ammoniavirescens presentan la misma organización interna descrita por Grenville & al. (1985) para P. involutus. Aunque estos autores observan depósitos lipídicos en todas las células de la médula, en nuestro caso solo se dan en las células próximas a la corteza.
Hay estudios que plantean que la producción de esclerocios está influenciada por la fertilización nitrogenada y por la temperatura, como los llevados a cabo por Ekblad & al. (1995), que observa una disminución de esclerocios al incrementar el nivel de fosfato diamónico. Nuestros resultados en la producción y desarrollo de esclerocios muestran que a 23 ºC, bajar la concentración de fosfato diamónico en el medio de cultivo MMN a la mitad —0,94 mM—, reduce considerablemente el número de esclerocios formados en cada placa de cultivo —de 19 a 3—; sin embargo, si con esa baja concentración de la sal se disminuye la temperatura hasta los 8 ºC, el número de estas estructuras puede ser mayor que el obtenido en las condiciones anteriores con mayor temperatura y concentración de sal —38—. Por otro lado, cuando se emplea el medio de cultivo MS, o con sus macronutrientes reducidos a la mitad —1/2 MS—, se consigue un incremento significativo de la producción de esclerocios a 8 ºC —100% de las placas con más de 40 esclerocios por placa—. Con estos datos parece evidente que la biogénesis de los esclerocios se produce cuando el micelio está sometido a algún tipo de estrés, como es en este caso la variación de nitrógeno y la disminución de temperatura.
Georgiou & al. (2006), a partir de sus trabajos con Sclerotium rolfsii, sugirieron que la producción de esclerocios por hongos filamentosos está inducida por el incremento del estrés oxidativo. Someter al micelio a determinados compuestos, como ácido yodoacético o yodatopotásico (Chet & Henis, 1968), y a factores ambientales, como la luz (Miller & Liberta, 1977), la temperatura (Rudolph, 1962) o la limitación de nutrientes, causa un incremento de las especies reactivas de oxígeno —ROS— y de la peroxidación de lípidos en el interior de la célula. Este hecho ha sido probado con diferentes especies de hongos filamentosos como Sclerotinia sclerotiorum, Rhizoctonia solani o Sclerotium rolfsii, pero no en especies ectomicorrícicas. Sería necesario realizar ensayos que determinasen, en las especies ectomicorrícicas, si el incremento de estrés oxidativo aumenta la producción de esclerocios.
La mayoría de los esclerocios obtenidos son inmaduros o maduros de pequeño tamaño, de forma similar a lo observado en el trabajo de Moore & Peterson (1992). En conclusión, parece evidente que la biogénesis de los esclerocios se produce cuando el micelio está sometido algún tipo de estrés como la variación de nitrógeno y la disminución de temperatura. Al igual que el micelio, los esclerocios también son capaces de servir como inóculo fúngico para micorrizar. De forma similar a los resultados de Peterson & (2004) con Pisolithus, los nuestros muestran que los esclerocios de P. ammoniavirescens también pueden ser utilizados tanto para generar micelio como para formar micorrizas in vitro en Betula celtiberica. Este hecho abre la puerta a un mejor aprovechamiento de las especies, ya que seríamos capaces de, a partir de un sistema de cultivo en placa, producir micelio y esclerocios que funcionen ambos como inóculo efectivo. Debido a esto, sería interesante inducir e incrementar su producción en el medio de cultivo.
En resumen, nuestros experimentos ponen de manifiesto la estructura interna de los esclerocios de P. ammoniavirescens y que la formación de esclerocios se ve influenciada por las características químicas del medio de cultivo y la temperatura de 8 ºC; además, que pueden ser utilizados como inóculo tanto para generar micelio como para micorrizar.
AGRADECIMIENTOSTOP
La realización de este trabajo no habría sido posible sin el apoyo y las instalaciones del laboratorio del área de Fisiología Vegetal del departamento de Biología de Organismos y Sistemas de la Universidad de Oviedo.
REFERENCIASTOP
| ○ |
Coley-Smith, J.R. & Cooke, R.C. 1971. Survival and germination of fungal sclerotia. Annual Review Phytopathology 9: 65-92. https://doi.org/10.1146/annurev.py.09.090171.000433.
|
| ○ |
Deacon, J.W. 2006. Fungal Biology ed. 4. Blackwell Publishing, Malden.
|
| ○ |
Ekblad, A., Wallander, H., Carlsson, R. & Huss-Danell, K. 1995. Fungal biomass in roots and extramatrical mycelium in relation to macronutrients and plant biomass of ectomycorrhizal Pinus sylvestris and Alnus incana. New Phytologist 131: 443-451. https://doi.org/10.1111/j.1469-8137.1995.tb03081.x.
|
| ○ |
Fernández, R., Bertrand, A., Casares, A., García, R., González A. & Tamés, R.S. 2008. Cadmium accumulation and its effect on the in vitro growth of woody fleabane and mycorrhized white birch. Environmental Pollution 152: 522-529. https://doi.org/10.1016/j.envpol.2007.07.011.
|
| ○ |
Fernández-Miranda, E. 2014. Hongos ectomocirrícicos de plantas leñosas en terrenos degradados de Asturias por actividad minera e industrial. Tesis Doctoral. Universidad de Oviedo, Oviedo.
|
| ○ |
Grenville, D.J., Peterson, R.L., & Piché, Y. 1985. The development, structure, and histochemistry of sclerotia of ectomycorrhizal fungi. II. Paxillus involutus. Canadian Journal of Botany 63: 1412-1417. https://doi.org/10.1139/b85-195.
|
| ○ |
Harvey, L.M. 1991. Cultural Techniques for Production of Ectomycorrhizal Fungi. Biotechnology Advances 9: 12-29.
|
| ○ |
Lev, R. & Spicer, S.S. 1964. Specific staining of sulphate groups with alcian blue at low pH. Journal of Histochemistry & Cytochemistry 12: 309-309. https://doi.org/10.1177/12.4.309.
|
| ○ |
Moore, A.E.P & Peterson, R.L. 1992. Effect of temperature on sclerotium induction in Paxillus involutus. Canadian Journal of Microbiology 38: 1197-1201. https://doi.org/10.1139/m92-197.
|
| ○ |
Pearse, A.G.E. 1968. Histochemistry. Theoretical and applied genetics 1: 1-759.
|
| ○ |
Peterson, R.L., Massicotte, H.B. & Melville, L.H. 2004. Mycorrhizas: Anatomy and Cell Biology. CABI Publishing Series, Nueva York.
|
| ○ |
Willetts, H.J. 1971. The survival of fungal sclerotia under adverse environmental conditions. Biological Reviews 46: 387-407. https://doi.org/10.1111/j.1469-185X.1971.tb01050.x.
|
Fig. 1. Paxillus ammoniavirescens: a, esclerocios inmaduros; b, esclerocios maduros; c, esclerocio inmaduro teñido con azul de algodón; d, interior de esclerocio maduro teñido con azul de algodón; e, esclerocio maduro teñido con azul de toluidina que muestra todas las capas; f, detalle de las diferentes capas que se observan en un esclerocio; g, detalle los acúmulos proteicos; h, esclerocio maduro teñido con azul de alcián que muestra la presencia de mucopolisacáridos en las células del interior de la médula; i, pequeños acúmulos periféricos de lípidos teñidos mediante Sudan Black B. [Escala: a = 3 mm; b = 400 μm; c = 150 μm; d = 300 μm; e, g = 500 μm; f = 250 μm, h = 20 μm, i = 5 μm.]