Anatomía vegetativa de Lophophytum mirabile subsp. bolivianum (Balanophoraceae) y efecto de su parasitismo en la anatomía de las raíces de su hospedante Anadenanthera colubrina var. cebil
Ana María González* & Héctor A. Sato
Instituto de Botánica del Nordeste UNNE-CONICET, Sargento Cabral 2131, CC 209, Corrientes, Argentina; anitama39@gmail.com
* Autor para la correspondencia.
| |
Resumen
González, A.M. & Sato, H.A. 2016. Anatomía vegetativa de Lophophytum mirabile subsp. bolivianum (Balanophoraceae) y efecto de su parasitismo en la anatomía de las raíces de su hospedante Anadenanthera colubrina var. cebil. Anales Jard. Bot. Madrid 73(2): e039.
El objetivo de este trabajo fue estudiar la estructura del cuerpo vegetativo de Lophophytum mirabile subsp. bolivianum (Wedd.) B. Hansen, analizar en qué grado se modifican las raíces de Anadenanthera colubrina var. cebil (Griseb.) Altschul cuando son infectadas y determinar los cambios anatómicos producidos por este parasitismo. Las plantas de L. mirabile subsp. bolivianum tienen un cuerpo vegetativo subterráneo o túber de forma esferoidal ahusada, que externamente es de un color castaño oscuro a negro y superficie verrugosa; carece de epidermis, estomas o tricomas. La matriz central del túber está compuesta por parénquima de reserva y abundantes haces colaterales dispersos. Las células del parásito ubicadas a nivel del cámbium de la raíz inician la formación de túberes, que surgen como exófitos del cuerpo del hospedante. En el leño de la raíz de A. colubrina var. cebil infectado por el parásito se pierde la identidad del sistema radial y axial del crecimiento secundario. Esto lleva a la formación de bucles de xilema que afectan el transporte y el desarrollo de la raíz, que detiene su crecimiento en longitud y desarrolla una agalla leñosa. La infección de L. mirabile subsp. bolivianum es causa de profundos cambios anatómicos en el desarrollo de la madera de A. colubrina var. cebil que favorecen el éxito del parásito.
Palabras clave: agallas,
anatomía,
leño,
parasitismo,
raíz.
|
| |
Abstract
González, A.M. & Sato, H.A. 2016. Vegetative anatomy of Lophophytum mirabile subsp. bolivianum (Balanophoraceae) and the effect of its parasitism in the anatomy of the roots of its host Anadenanthera colubrina var. cebil. Anales Jard. Bot. Madrid 73(2): e039.
The objectives of this work were to study the structure of the vegetative body of Lophophytum mirabile subsp. bolivianum (Wedd.) B. Hansen, to analyze the change on roots of Anadenanthera colubrina var. cebil (Griseb.) Altschul when they are infected by this parasitic plant, and to identify the anatomical changes produced by that parasitism. L. mirabile subsp. bolivianum plants are formed by a spheroidal-narrower underground vegetative body or tuber, that externally has a dark warty surface;epidermis, stomata or trichomes are lacking. The central matrix of tuber consists of reserving parenchyma and vascular bundles. Parasitic cells located at the level of root cambium initiate the tuber formation. On the infected root of A. colubrina var. cebil, the identity of radial and axial growth of the secondary system are lost. This leads to the formation of xylem loops that affect the xylem transport and root development, which stops length growth and develops a woody gall. Infection of L. mirabile subsp. bolivianum causes profound anatomical changes in timber developing of A. colubrina var. cebil, which favor the parasite success.
Key words: Anatomy,
guts,
log,
root,
parasitism.
|
INTRODUCCIÓNTOP
Una planta holoparásita es aquella que penetra el tejido —tallos o raíces— de su hospedante mediante un haustorio y deriva
la totalidad del agua y los nutrientes que requiere. Carecen de clorofila y, por ende, de capacidad de realizar fotosíntesis,
por lo que son organismos heterótrofos y su parasitismo es obligado. De acuerdo con Kuijt (1969) y Musselman & Press (1995), hay unas 3000 especies de plantas parásitas, que representan aproximadamente el 1% de las plantas con flores. Estudios actuales
elevan este número a 4423 especies, repartidas en 277 géneros (Nickrent & Musselman, 2004; Jørgensen, 2008).
La familia Balanophoraceae L.C. Richard & A. Richard tiene una distribución tropical o subtropical (más rara en las zonas
templadas) e incluye 18 géneros y 43 especies (Hansen, 1980). Nickrent & al. (1997, 2010) reconocen 17 géneros con aproximadamente 42 especies, mientras que Kuijt & Hansen (2015) sólo 16 géneros. Lophophytum Schott & Endl. es un género exclusivamente sudamericano con 5 táxones: L. leandri Eichler, L. mirabile Schott & Endl. subsp. mirabile, L. mirabile subsp. bolivianum (Wedd.) B. Hansen (L. bolivianum Wedd., basión.), L. rizzoi Delprete y L. weddellii Hook. f. (Cocucci, 1984; Xifreda, 1999; Zuloaga & al., 2008; Sato, 2015).
Algunas holoparásitas se encuentran casi por completo embebidas dentro de los tejidos de su hospedante como endófitos y son
sólo sus flores las únicas partes externas o exófitos; en otras predomina el cuerpo vegetativo externo y hay un escaso desarrollo
del endófito (Heide-Jørgensen, 2008). Este último caso es el de las Balanophoraceae, plantas herbáceas que parasitan raíces, principalmente de árboles y arbustos.
Todas las especies de esta familia desarrollan un cuerpo vegetativo subterráneo llamado túber, que está conectado a la raíz
de su hospedante por una unión discreta. El túber carece de las estructuras típicas de la organización cormofítica, es decir,
no tiene raíz, tallo y hojas diferenciados, es de forma variada y está ramificado en algunas especies (Kuijt & Hansen, 2015).
La constitución del túber en la familia es muy variable: en los géneros Helosis Rich., Lophophytum, Ombrophytum Poepp. y Scybalium Schott & Endl., está formado exclusivamente por tejidos del parásito (Mauseth & al., 1992; Hsiao & al., 1993; Heide-Jørgensen, 2008; González & Mauseth, 2010); mientras que en Balanophora J.R. Forst. & G. Forst. y Langsdorffia Mart. es una mezcla de células del parásito y el hospedante (Kuijt, 1969; Shivamurthy & al., 1981; Gedalovich-Shedletzky & Kuijt, 1990; Hsiao & al., 1994). El modo de establecimiento e infección a partir de semillas es poco conocido, excepto en Balanophora y Dactylanthus Hook f. (Kuijt & Hansen, 2015). En algunos géneros, como Helosis y Ombrophytum, hay estructuras rizomatozas subterráneas (llamados runners) capaces de producir nuevas infecciones de modo vegetativo (Mauseth & al., 1992; Hsiao & al. 1994). Otro aspecto bastante desconocido es la extensión del endófito en los representantes de esta familia (Kuijt & Hansen, 2015).
Las inflorescencias en esta familia son únicas entre las plantas con flores, ya que se originan de modo endógeno con respecto a su cuerpo vegetativo. En general son las únicas porciones que emergen del nivel del suelo y presentan un gran número de flores unisexuales y minúsculas (Kuijt, 1969; Gonzalez & Mauseth, 2010; Kuijt & Hansen, 2015; Sato, 2015).
El único estudio de la estructura y anatomía del cuerpo vegetativo en el género Lophophytum fue realizado en L. leandri por González & Mauseth (2010), quienes la calificaron de “aberrante” y caracterizaron por la falta de estructuras habituales, como tallos y hojas, y de células relacionadas con el proceso fotosintético, como los estomas. También analizaron la conexión con el hospedante Parapiptadenia rigida Benth. (Fabaceae) y las modificaciones que el parásito provoca en las raíces del árbol. En L. leandri, González & Mauseth (2010) observaron que los tejidos del parásito pueden extenderse dentro del floema del hospedante y originar nuevos túberes.
Lophophytum mirabile subsp. bolivianum vive en el noroeste de Argentina (Salta y Jujuy), Bolivia y Paraguay, a expensas de árboles de la familia Fabaceae; en la literatura no se menciona especificidad con el hospedante. Durante el desarrollo de su tesis doctoral, Sato (2015) indicó que crece asociado exclusivamente con Anadenanthera colubrina var. cebil (Griseb.) Altschul (Acacia cebil Griseb., basión.), especie que forma asociaciones boscosas.
Los objetivos de este trabajo fueron: estudiar la estructura del cuerpo vegetativo de L. mirabile subsp. bolivianum, estudiar en qué grado se modifican las raíces de A. colubrina var. cebil cuando son infectadas y determinar los cambios anatómicos producidos por dicho parasitismo. A fin de determinar el alcance de la relación, también se estudiaron raíces no parasitadas. Los resultados se comparan con los conocidos en la asociación
entre L. leandri y Parapiptadenia rigida, además de con otros géneros de Balanophoraceae descritos.
MATERIAL Y MÉTODOSTOP
Para el presente estudio se seleccionaron 19 ejemplares de L. mirabile subsp. bolivianum que parasitaban A. colubrina var. cebil. Con la finalidad de realizar un análisis comparativo se tomaron, además, 7 muestras de raíces de árboles no infestados que crecían en las mismas localidades que las plantas parasitadas. Todos especímenes estudiados fueron depositados en el herbario C.L. Cristóbal (CTES) del Instituto de Botánica del Nordeste. El material estudiado se lista a continuación:
Lophophytum mirabile subsp. bolivianum. ARGENTINA. Jujuy: Dpto. Ledesma, Parque Nacional Calilegua, Zona Sur, Aº Aguas Negras, Sato 4, 433, 434, 435 y 436. Ibidem, Sector Este, Subsector Caimancito a orillas de camino de entrada y orillas de río, Sato 3. Sendero Teta, Sato 11. Ibidem, entrada al cámping Aguas Negras, Sato 67, 68, 257, 267 y 273. Ibidem, Zona sur, Sato 99, 128, 296 y 300; González 300. ARGENTINA. Salta: Dpto. Rivadavia, Municipio Aguaray, Caraparí, Sato 202. BOLIVIA. Santa Cruz: Ciudad de Santa Cruz, Sato 426.
Anadenanthera colubrina var. cebil. ARGENTINA. Jujuy: Dpto. Ledesma, Parque Nacional Calilegua, Sector Este, subsector Caimancito, Sato 2. Ibidem, Sector Aguas Negras, cámping, Sato 23 y 433. Ibidem, Sector Aguas Negras, sendero Herradura, Sato 435. Ibidem, sendero El Pedemontano, Sato 265. Ibidem, Zona Sur, Río Colorado, Sato 429. BOLIVIA. Santa Cruz: Santa Cruz de la Sierra, Sato 428.
También se estudiaron los ejemplares de L. mirabile subsp. bolivianum conservados en los herbarios CTES, FCQ, JUA, LIL, LPB, MCNS, SI y USZ, a fin de recabar información sobre el hospedante.
Anadenanthera colubrina var. cebil (Griseb.) Altschul es un árbol de 10 a 25 m de altura, caducifolio e inerme, que crece en el bosque pedemontano hasta los 700 m de altitud y es considerado fijador de laderas. Es una especie de amplia distribución en las provincias del norte de Argentina (Catamarca, Chaco, Corrientes, Córdoba, Entre Ríos, Formosa, Jujuy, Misiones, Salta, Santiago del Estero y Tucumán), además del sur de Bolivia y Paraguay (Alto Paraguay, Amambay, Caaguazú, Canindeyú, Central, Concepción, Cordillera, Paraguarí, Presidente Hayes y San Pedro), Brasil (Paraná y Rio Grande Do Sul). Lophophytum mirabile crece exclusivamente en la región de Jujuy y Salta en Argentina, entre los 450 y 600 m de altitud. Martínez & al. (2013) publicaron que ambas variedades de A. colubrina (Vell.) Brenan (Mimosa colubrina Vell., basión.), A. colubrina var. colubrina y A. colubrina var. cebil, conviven en el área de distribución de L. mirabile; todos los ejemplares parasitados pertenecen a la variedad cebil.
Para los estudios anatómicos se recolectaron raíces sanas e infestadas del árbol y el túber e inflorescencias del parásito, que fueron fijados en FAA (alcohol 70º, ácido acético y formol, 90:5:5). El cuerpo del parásito fue seccionado en trozos de menos de 5 cm y mantenido en líquido fijador como mínimo una semana antes de ser almacenado en alcohol 70º. Para las observaciones de microscopía óptica (MO), las muestras se cortaron en bloques de 0,7 cm3 y se deshidrataron e infiltraron con parafina; en el túber se seleccionaron todas las zonas del mismo, desde la periferia hacia el interior. Los materiales se procesaron utilizando deshidratantes histológicos (González & Cristóbal, 1997), la infiltración en parafina se realizó según la técnica de Johansen (1940). Se efectuaron cortes seriados transversales (CT) y longitudinales (CL) con micrótomo rotativo de 12-15 μm de espesor. Debido a la dureza del material los tiempos de infiltración se incrementaron, dejando el material en parafina por lapsos de 8 horas, con tres cambios. No se utilizaron tratamientos para ablandar el material, ya que los mismos afectan normalmente a los componentes del citoplasma y desvirtúan el análisis. Al tratarse de materiales duros o con una mezcla de tejidos de diferentes durezas, la principal dificultad derivada de su selección es la tendencia a que cada corte se enrolle sobre la cuchilla, además de la posibilidad de rotura con su extensión. Para soslayar este inconveniente, antes de efectuar cada corte, se aplicó con pincel una solución acuosa de detergente neutro al 3% a la superficie expuesta del material impregnado en parafina; este líquido funciona de agente humectante y posibilita el deslizamiento de la sección sobre la superficie de la cuchilla. Además, se acompañó el corte con un pincel embebido en la solución tensoactiva, lo que evita su enrollamiento y facilita su montaje. Las secciones fueron adheridas a portaobjetos con adhesivo de Haupt (Johansen, 1940). Se utilizó la coloración safranina-astra blue (Luque & al., 1996) y safranina-fast green (Johansen, 1940); los cortes se montaron con bálsamo de Canadá sintético.
La presencia de almidón se constató con microscopio óptico con luz polarizada y reacción con lugol; se utilizó floroglucinol para identificar lignina y Sudán IV para grasas (Johansen, 1940). La identificación de taninos se realizó con FeSO4 (Ruzin, 1999). Para las observaciones se utilizó un microscopio óptico Leica MZ6 con sistema de captura digital de imágenes.
RESULTADOSTOP
Lophophytum mirabile subsp. bolivianumTOP
El cuerpo vegetativo o túber de L. mirabile subsp. bolivianum se encuentra, en general, por debajo de los primeros 20 cm de suelo y próximo al tronco del árbol. El túber es de forma esferoidal-ahusada, de 4(9,5)-15 × 3(6,5)-10 cm (fig. 1 a, b, j, k). La superficie externa es de un color castaño de obscuro a negro, con verrugas poligonales de tamaño variable, de 0,4 a 1,2 cm (fig. 1 b, d, j-k). La zona verrugosa tienen un espesor de 1,8-2,2 mm, hasta de unos 3,2 mm en los túberes de mayor tamaño; el mayor espesor coincide con la zona central de la verruga (fig. 1 e). El interior del túber es de un blanco que se torna de color castaño (fig. 1 c, e, f). El túber es sésil y se encuentra sujeto a la raíz por medio de un área de menos de 5 cm de diámetro, con un diseño coralino
(fig. 1 g, h, k).
|
 Fig. 1. Morfología de Lophophytum mirabile subsp. bolivianum y Anadenanthera colubrina var. cebil: a, b, túber de L. mirabile subsp. bolivianum con inflorescencia jóven; c, túber fresco mostrando matriz interna; d, detalle de inflorescencia emergiendo entre verrugas; e, detalle de zona verrugosa y matriz en túber fresco; f, zonación en túber fijado en FAA; g, interfase entre L. mirabile subsp. bolivianum y A. colubrina en vista superficial; h, detalle del diseño coraloide de la interfase; i, inflorescencia, emergencia del suelo; j, raíz con túber portador de 5 inflorescencias aún cubiertas por escamas; k, túber con dos inflorescencias desprovistas de escamas, mostrando raquices con flores pistiladas (p), estaminadas (e) y lugar de la interfase (flecha). Abreviaturas: m: matriz, zv: zona verrugosa, zt: zona de transición. Escalas: a-d, g = 1cm; f = 2,5 cm; e, h = 1mm; i-k = 10 cm. Fig. 1. Morfología de Lophophytum mirabile subsp. bolivianum y Anadenanthera colubrina var. cebil: a, b, túber de L. mirabile subsp. bolivianum con inflorescencia jóven; c, túber fresco mostrando matriz interna; d, detalle de inflorescencia emergiendo entre verrugas; e, detalle de zona verrugosa y matriz en túber fresco; f, zonación en túber fijado en FAA; g, interfase entre L. mirabile subsp. bolivianum y A. colubrina en vista superficial; h, detalle del diseño coraloide de la interfase; i, inflorescencia, emergencia del suelo; j, raíz con túber portador de 5 inflorescencias aún cubiertas por escamas; k, túber con dos inflorescencias desprovistas de escamas, mostrando raquices con flores pistiladas (p), estaminadas (e) y lugar de la interfase (flecha). Abreviaturas: m: matriz, zv: zona verrugosa, zt: zona de transición. Escalas: a-d, g = 1cm; f = 2,5 cm; e, h = 1mm; i-k = 10 cm.
|
|
Cada túber forma generalmente una inflorescencia de origen endógeno, aunque eventualmente puede haber hasta 6 inflorescencias
por planta (fig. 1 a, b, d, i-k). La emergencia de inflorescencias ocurre entre los meses de noviembre y febrero, período que coincide con el ciclo reproductivo
del hospedante y con la estación lluviosa del área estudiada. Las inflorescencias tienen un pedúnculo columnar de (2)21-40
cm que eleva el eje principal o raquis primario de la superficie del suelo. En la axila de cada bráctea del raquis primario
se insertan ramas secundarias cortas o raquis secundarios, portadoras de flores unisexuales, las proximales con flores pistiladas
y las distales con flores estaminadas (fig. 1 k). Las escamas se desprenden cuando las flores maduran (fig. 1 j, k).
Anatomía del túberTOP
El túber está enteramente constituido por células de L. mirabile subsp. bolivianum y tiene una matriz central donde se destaca la presencia de abundantes haces vasculares y una delgada banda externa sin haces vasculares o zona de transición con una superficie verrugosa externa (fig. 1 e, f).
La matriz central está compuesta por parénquima de reserva y abundantes haces colaterales dispersos (fig. 2 a). Las células parenquimáticas de la matriz se disponen de modo compacto, sin dejar espacios intercelulares, con paredes celulósicas delgadas y núcleo de 3,7-4,4 μm de diámetro. El citoplasma se caracteriza por una densa y uniforme tonalidad rosa, las vacuolas de contenido claro se encuentran desplazadas hacia la periferia y hay abundantes granos de almidón compuestos de 2-6 elementos, con hilo notable en cada elemento (fig. 2 b, c). Hacia la periferia de la matriz central, el contenido citoplasmático se condensa y adquiere una apariencia grumosa, se mantiene la presencia de núcleo y granos de almidón; las pruebas histoquímicas demostraron la presencia de grasas y almidón en estas células (fig. 2 d).
|
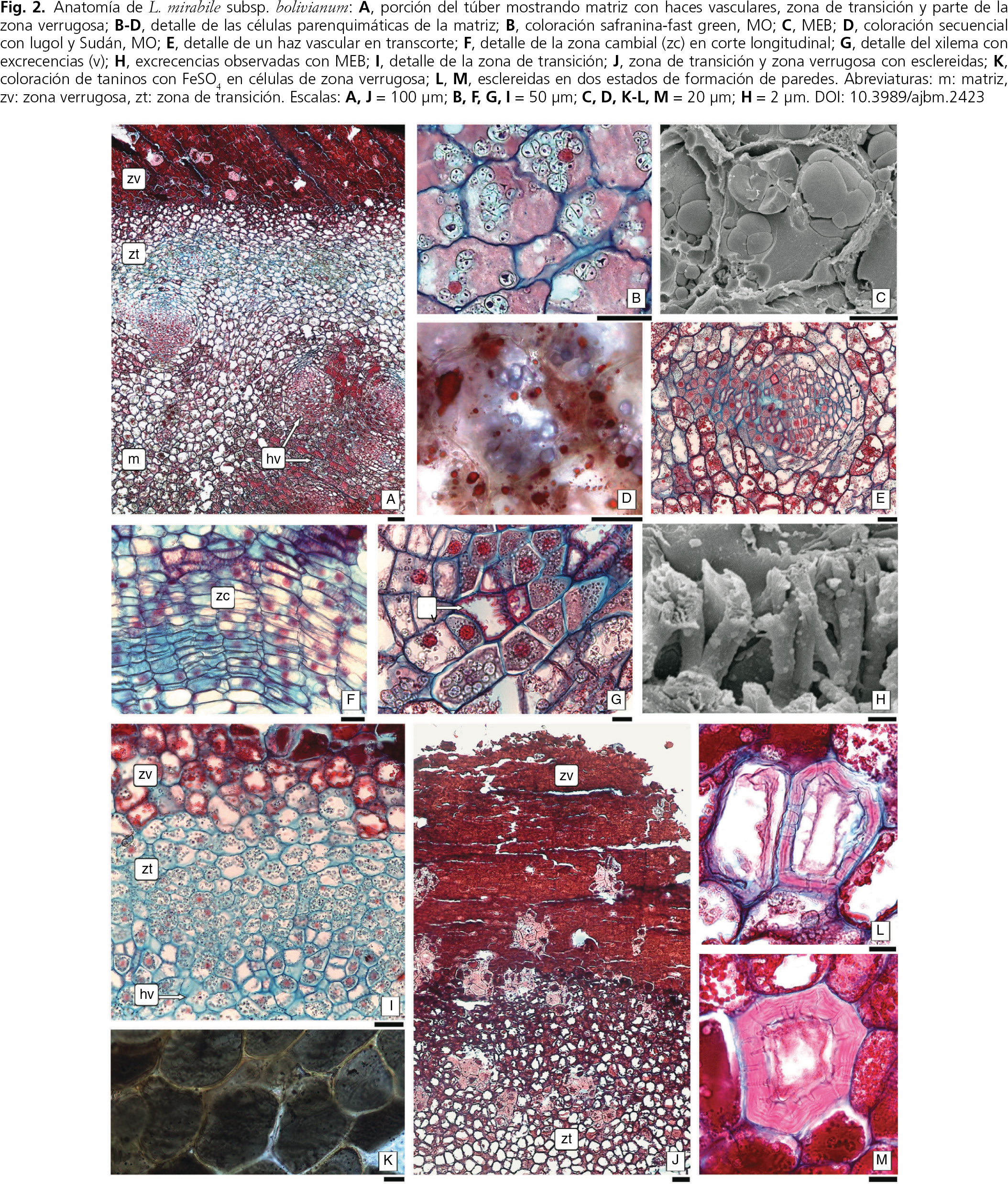 Fig. 2. Anatomía de Lophophytum mirabile subsp. bolivianum: a, porción del túber mostrando matriz con haces vasculares, zona de transición y parte de la zona verrugosa; b-d, detalle de las células parenquimáticas de la matriz; b, coloración safranina-fast green, MO; c, MEB; d, coloración secuencial con lugol y Sudán, MO; e, detalle de un haz vascular en transcorte; f, detalle de la zona cambial (zc) en corte longitudinal; g, detalle del xilema con excrecencias (v); h, excrecencias observadas con MEB; i, detalle de la zona de transición; j, zona de transición y zona verrugosa con esclereidas; k, coloración de taninos con FeSO4 en células de zona verrugosa; l, m, esclereidas en dos estados de formación de paredes. Abreviaturas: m: matriz, zv: zona verrugosa, zt: zona de transición. Escalas: a, j = 100 μm; b, f, g, i = 50 μm; c, d, k-m = 20 μm; h = 2 μm. Fig. 2. Anatomía de Lophophytum mirabile subsp. bolivianum: a, porción del túber mostrando matriz con haces vasculares, zona de transición y parte de la zona verrugosa; b-d, detalle de las células parenquimáticas de la matriz; b, coloración safranina-fast green, MO; c, MEB; d, coloración secuencial con lugol y Sudán, MO; e, detalle de un haz vascular en transcorte; f, detalle de la zona cambial (zc) en corte longitudinal; g, detalle del xilema con excrecencias (v); h, excrecencias observadas con MEB; i, detalle de la zona de transición; j, zona de transición y zona verrugosa con esclereidas; k, coloración de taninos con FeSO4 en células de zona verrugosa; l, m, esclereidas en dos estados de formación de paredes. Abreviaturas: m: matriz, zv: zona verrugosa, zt: zona de transición. Escalas: a, j = 100 μm; b, f, g, i = 50 μm; c, d, k-m = 20 μm; h = 2 μm.
|
|
Los haces vasculares son colaterales y se encuentran distribuidos al azar (fig. 2 a, e); sólo los periféricos tienen el floema orientado hacia el exterior. Los haces están rodeados por una vaina de células parenquimáticas, con escasos granos de almidón, que contribuyen al aumento de volumen del túber y cuyos planos de división son tangentes al haz. Los haces de mayor tamaño presentan “colas” de xilema y floema primario, éste último colapsado por el parénquima que lo rodea. Una zona cambial de 4-6 capas de espesor se encuentra entre xilema y floema, con células que se caracterizan por su forma rectangular y aplanada que indica la frecuencia de divisiones tangenciales, un núcleo grande de 16-18 μm de diámetro y un citoplasma claro y sin organelas visibles al MO (fig. 2 e). No se observa diferenciación en células iniciales radiales y fusiformes (fig. 2 e-g). En un corte longitudinal es muy evidente la estratificación del cámbium y los tejidos vasculares derivados (fig. 2 f). El xilema está formado por elementos de vasos y abundante parénquima. Los miembros de vasos son cortos, sus paredes lignificadas poseen diseño reticulado con excrecencias que invaden el lumen, y las placas de perforación son simples (fig. 2 g, h). Las células del parénquima xilemático poseen un núcleo conspicuo hasta de 15 μm y abundante almidón en forma de granos compuestos cuyo tamaño no supera 3 μm (fig. 2 g). El floema es predominantemente parenquimático pero, a diferencia del que acompaña al xilema, las células carecen de almidón y su núcleo es de menor volumen.
Las ramas vasculares que llegan a la periferia de la matriz central están formadas sólo por algunos miembros de vasos y parénquima sin sustancias tánicas y con granos de almidón compuestos, con 2-12 elementos cada uno e hilo conspicuo. A partir de este parénquima se desarrolla una zona de transición de características meristemáticas que forma el límite entre la matriz central y la zona verrugosa del túber y, si bien no se observan figuras mitóticas, la orientación de las paredes muestra una tendencia a la estratificación (fig. 2 i). Las células derivadas de este parénquima se diferenciarán en parénquima tanífero y braquiesclereidas que forman la zona verrugosa (fig. 2 i, j).
Anatómicamente la zona verrugosa carece de epidermis, estomas o tricomas (fig. 2 j). Está compuesta por un número variable de células parenquimáticas compactas sin espacios intercelulares, poseen paredes delgadas y celulósicas y citoplasma completamente tanífero (fig. 2 j). En las células de las capas superficiales el citoplasma está completamente ocupado por contenido tanífero, lo que oculta cualquier otro elemento citoplasmático (fig. 2 k). Las briquiesclereidas se diferencian inicialmente de manera aislada y el continuo aporte de nuevas células del estrato meristemático las empuja hacia el exterior del túber; las células periféricas a las esclereidas también pueden diferenciarse en células esclerosadas y constituir nidos esclerosados (fig. 2 j). Estas esclereidas poseen paredes secundarias lignificadas donde se evidencian las sucesivas capas de deposición de paredes; las puntuaciones inicialmente son simples y luego se anastomosan constituyendo puntuaciones ramificadas (fig. 2 l, m). El núcleo está presente mientras se depositan los estratos de pared secundaria y se lignifican; las esclereidas más viejas ubicadas hacia la periferia del estrato tanífero y cerca de la superficie del túber, tienen un lumen ocluido con sustancias tánicas. Las capas exteriores de la zona verrugosa se desprenden progresivamente del túber.
Anadenanthera colubrina var. cebilTOP
Las raíces no infectadas presentan el leño caracterizado por la presencia de vasos grandes, con un diámetro tangencial promedio de 110 μm (76-164 μm), dispuestos en grupos de 1-3 elementos, con porosidad difusa, y una densidad de 60-68 vasos/mm2 (fig. 3 a, b). Los miembros de vasos poseen placas de perforación simples y puntuaciones areoladas con abertura interna ornada (fig. 3 c, d). El tejido mecánico es una matriz de fibras libriformes. El parénquima paratraqueal es vasicéntrico y aliforme, con tendencia a confluente (fig. 3 b). El parénquima apotraqueal es escaso y está dispuesto en bandas de 1 o 2 células de espesor. El floema presenta estratos tangenciales donde alternan miembros de tubos cribosos, células parenquimáticas, células cristalíferas y fibras (fig. 3 e, f). Los radios son uni o biseriados, homogéneos y se presentan tanto en xilema como en floema. La zona cambial se encuentra bien definida con 4-6 células de espesor, formadas por iniciales fusiformes y radiales.
|
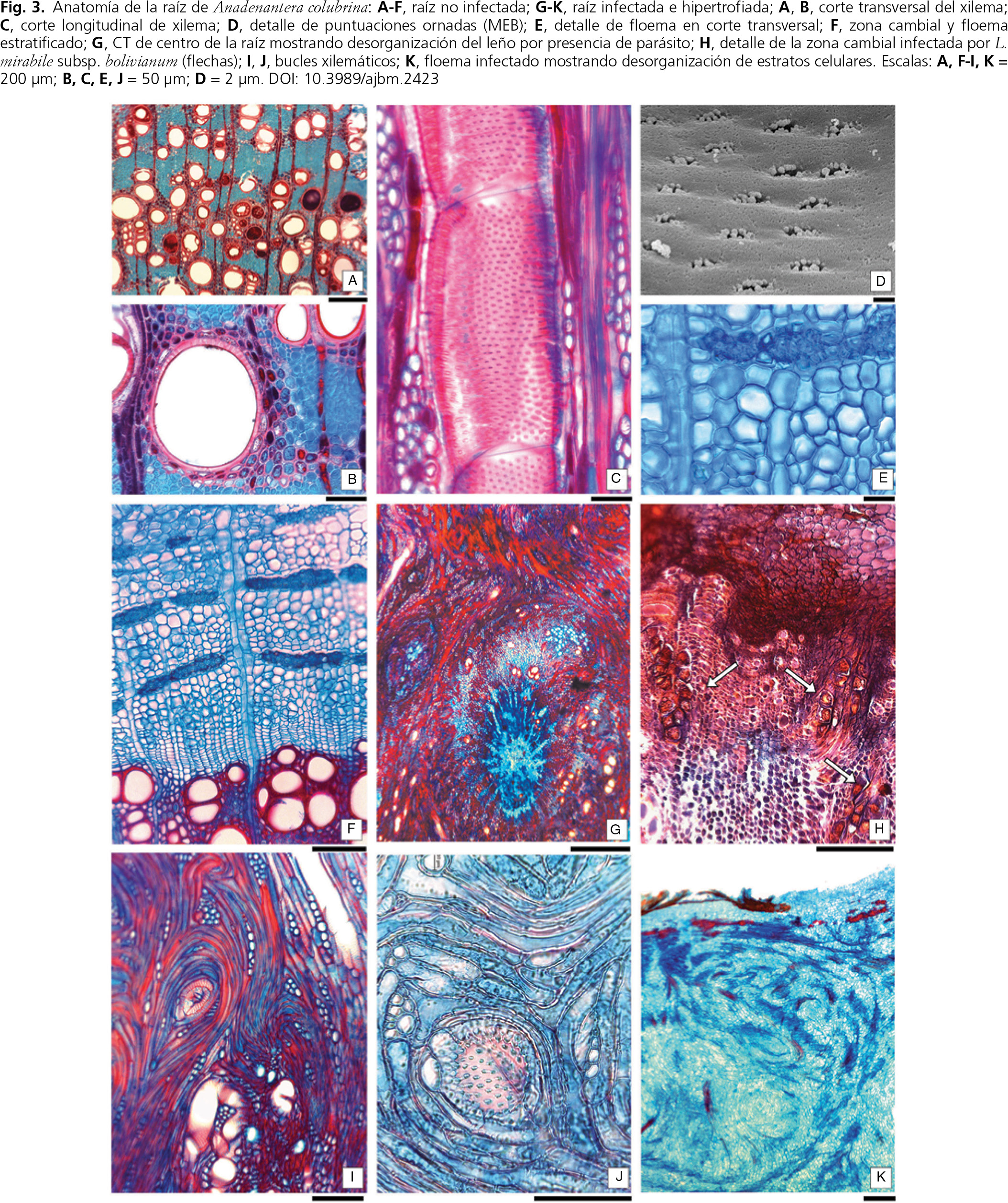 Fig. 3. Anatomía de la raíz de Anadenantera colubrina var. cebil: a-f, raíz no infectada; g-k, raíz infectada e hipertrofiada; a, b, corte transversal del xilema; c, corte longitudinal de xilema; d, detalle de puntuaciones ornadas (MEB); e, detalle de floema en corte transversal; f, zona cambial y floema estratificado; g, CT de centro de la raíz mostrando desorganización del leño por presencia de parásito; h, detalle de la zona cambial infectada por Lophophytum mirabile subsp. bolivianum (flechas); i, j, bucles xilemáticos; k, floema infectado mostrando desorganización de estratos celulares. Escalas: a, f-i, k = 200 μm; b, c, e, j = 50 μm; d = 2 μm. Fig. 3. Anatomía de la raíz de Anadenantera colubrina var. cebil: a-f, raíz no infectada; g-k, raíz infectada e hipertrofiada; a, b, corte transversal del xilema; c, corte longitudinal de xilema; d, detalle de puntuaciones ornadas (MEB); e, detalle de floema en corte transversal; f, zona cambial y floema estratificado; g, CT de centro de la raíz mostrando desorganización del leño por presencia de parásito; h, detalle de la zona cambial infectada por Lophophytum mirabile subsp. bolivianum (flechas); i, j, bucles xilemáticos; k, floema infectado mostrando desorganización de estratos celulares. Escalas: a, f-i, k = 200 μm; b, c, e, j = 50 μm; d = 2 μm.
|
|
La raíz donde se instala el parásito detiene su crecimiento y elongación después de la infección y se produce una proliferación localizada de la madera que forma una agalla leñosa (fig. 1 j).
El desarrollo de túberes de L. mirabile subsp. bolivianum siempre se observó en raíces leñosas, de más de 1 cm de diámetro, sin embargo, las células de L. mirabile subsp. bolivianum aparecen muy profundas en los transcortes y se las llega a encontrar en el límite entre xilema primario y secundario (fig. 3 g).
La infección se focaliza en el cámbium, donde las células del parásito se dividen intensamente produciendo una fuerte ondulación de la zona cambial (fig. 3 h). Una de las principales consecuencias de la infección es la alteración de los sistemas axiales y radiales típicos del leño secundario (fig. 3 i-k). En el xilema afectado, los vasos son estrechos y abundantes y se orientan en anillos concéntricos. Las fibras de relleno entre los vasos se reemplazan por células parenquimáticas lignificadas, con la misma distribución circular de los vasos (fig. 3 i, j).
En el floema infestado, las bandas tangenciales descritas en el leño normal son reemplazadas casi completamente por células parenquimáticas, hay muy pocas fibras y células con cristales, desorganizadas y dispersas, y no se detectaron miembros de tubos cribosos (fig. 3 k).
Formación del túber e interfase de parásito y hospedanteTOP
Con el crecimiento de los tejidos, tanto del hospedante como del parásito, las células de L. mirabile subsp. bolivianum localizadas inicialmente en el cámbium invaden ambos tejidos conductores y forman pequeñas agrupaciones (fig. 4 a). Estas células, de características parenquimáticas y pared delgada, son fácilmente identificables por su núcleo de gran tamaño, que supera 14 μm de diámetro, lo que permite diferenciarlas claramente del parénquima de A. colubrina var. cebil, cuyas células tienen núcleos de menos de 5 μm (fig. 4 b, d).
|
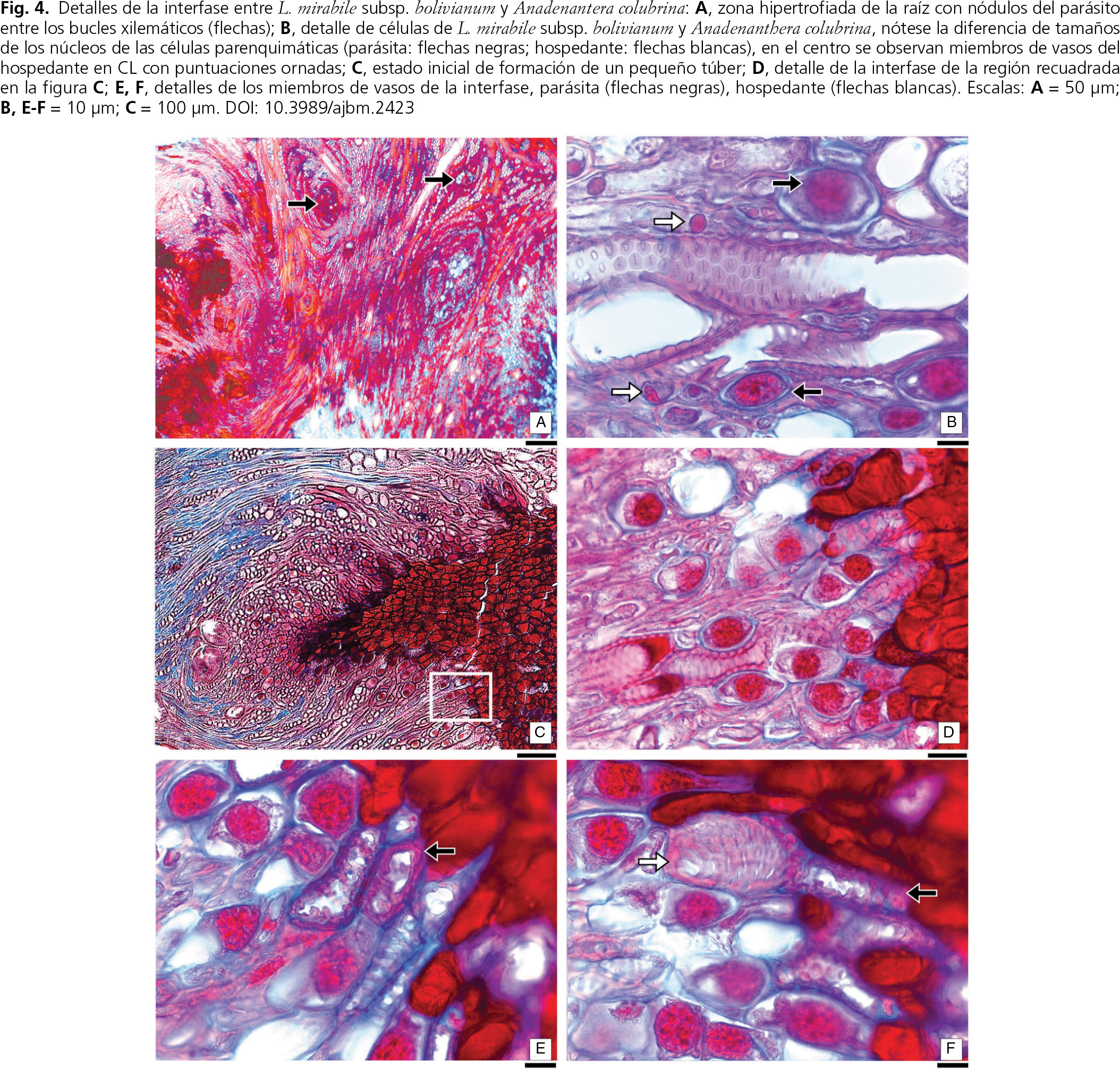 Fig. 4. Detalles de la interfase entre Lophophytum mirabile subsp. bolivianum y Anadenantera colubrina var. cebil: a, zona hipertrofiada de la raíz con nódulos del parásito entre los bucles xilemáticos (flechas); b, detalle de células de L. mirabile subsp. bolivianum y A. colubrina var. cebil, nótese la diferencia de tamaños de los núcleos de las células parenquimáticas (parásita: flechas negras; hospedante: flechas blancas), en el centro se observan miembros de vasos del hospedante en CL con puntuaciones ornadas; c, estado inicial de formación de un pequeño túber; d, detalle de la interfase de la región recuadrada en la figura c; e, f, detalles de los miembros de vasos de la interfase, parásita (flechas negras), hospedante (flechas blancas). Escalas: a = 50 μm; b, e, f = 10 μm; c = 100 μm. Fig. 4. Detalles de la interfase entre Lophophytum mirabile subsp. bolivianum y Anadenantera colubrina var. cebil: a, zona hipertrofiada de la raíz con nódulos del parásito entre los bucles xilemáticos (flechas); b, detalle de células de L. mirabile subsp. bolivianum y A. colubrina var. cebil, nótese la diferencia de tamaños de los núcleos de las células parenquimáticas (parásita: flechas negras; hospedante: flechas blancas), en el centro se observan miembros de vasos del hospedante en CL con puntuaciones ornadas; c, estado inicial de formación de un pequeño túber; d, detalle de la interfase de la región recuadrada en la figura c; e, f, detalles de los miembros de vasos de la interfase, parásita (flechas negras), hospedante (flechas blancas). Escalas: a = 50 μm; b, e, f = 10 μm; c = 100 μm.
|
|
Algunos de estos grupos de células de L. mirabile subsp. bolivianum ubicados en la zona cambial de la raíz, inician el crecimiento de un nódulo formando esencialmente por células taníferas y miembros de vasos (fig. 4 c). La zona de contacto o interfase entre parásito y árbol tiene células de ambos individuos (fig. 4 c-f). Anadenatera colubrina var. cebil presenta los miembros de vasos con las típicas puntuaciones areoladas ornadas y parénquima con núcleos pequeños mientras que L. mirabile subsp. bolivianum tiene miembros de vasos reconocibles por las excrecencias de las paredes y las células con núcleos grandes y citoplasma tanífero. En la interfase se encuentran en estrecho contacto las células de ambos individuos, tanto los lúmenes de los miembros de vasos entre sí, como con el citoplasma de las respectivas células parenquimáticas (fig. 4 d-f); no hay ninguna limitación física aparente para que se produzca el intercambio de sustancias entre parásito y hospedante a través de las comunicaciones intercelulares.
El nódulo de la parásita, iniciado profundamente en la región cambial, crece a través del floema y peridermis hasta emerger de la raíz y constituir el túber, exófito de la planta parásita (fig. 1 d). En la parte externa, la interfase entre ambos individuos presenta un diseño coraloide, visible a simple vista cuando se separan los túberes de la agalla leñosa de A. colubrina var. cebil (fig. 1 g, h, k). En el floema de la raíz infectada del área cercana a un túber desarrollado, se observan cientos de pequeños nódulos formados por células de L. mirabile subsp. bolivianum, que constituyen reservorios del parásito que podrán originar nuevos túberes. En ninguna raíz infestada se encontraron células de L. mirabile subsp. bolivianum cercanas a la peridermis o sobre ella, por lo que no es posible especular si dichas células provienen de una infección iniciada por una semilla.
DISCUSIÓN Y CONCLUSIONESTOP
Las observaciones realizadas en el material estudiado permiten afirmar que A. colubrina var. cebil es el hospedante que sostiene las comunidades de L. mirabile subsp. bolivianum, al menos en las regiones argentinas donde crecen estos táxones. El material de herbario estudiado de L. mirabile subsp. bolivianum no registra el hospedante.
El cuerpo de las holoparásitas es muy variable y va desde especies en las que predomina el desarrollo exófito, como pasa en la familia Hydnoraceae C. Agardh (Meijer, 1993a; Tennakoon & al., 2007), hasta casos extremos de desarrollo del endófito, como en las familias Rafflesiaceae Dum., Mitrastemonaceae Makino, Apodanthaceae Tiegh. ex Takht. y Cytinaceae A. Rich. (Kuijt, 1969; Meijer, 1993b; Bellot & Renner, 2014; Kuijt & Hansen, 2015), donde únicamente emergen las flores del interior del hospedante. Tras el análisis de la organización de L. mirabile subsp. bolivianum se comprobó que su cuerpo es predominantemente exófito, ya que el túber (cuerpo vegetativo) y las inflorescencias (cuerpo reproductivo) se desarrollan fuera del hospedante. Esta organización estructural es compartida por todos los géneros de la familia Balanophoraceae (Moore, 1940; Kuijt, 1969; Hsiao & al., 1993, 1994; Heide-Jørgensen, 2008). La constante de este tipo de estructuras vegetativas es la falta de órganos típicamente asociados al proceso fotosintético (Kuijt, 1969; Kuijt & Hansen, 2015).
Anatómicamente el túber de L. mirabile subsp. bolivianum carece de meristemas con organización túnica-corpus clásica y su crecimiento está basado principalmente en la proliferación del parénquima asociado a los haces de conducción, siendo éste el responsable del crecimiento en volumen. La superficie del túber carece de epidermis y se encuentra protegida por un estrato verrugoso formado a partir de un meristema periférico, cuya organización es similar a un felógeno, con una producción constante de células taníferas y esclereidas que se desprenden a medida que crece el túber. No hay estructuras dérmicas especializadas en el intercambio gaseoso como estomas o lenticelas y tampoco tiene un sistema de espacios intercelulares en la zona verrugosa exterior que facilite el intercambio gaseoso. A pesar de estas profundas modificaciones, el sistema vascular del túber está profusamente desarrollado y presenta desarrollo morfogenético usual de sus tejidos: en cada hacecillo se reconoce la presencia de xilema floema y cámbium fascicular.
Las características anatómicas vegetativas de L. mirabile subsp. bolivianum concuerdan con las encontradas en L. leandri, única especie analizada del género (González & Mauseth, 2010). A nivel morfológico, las diferencias radican en la forma del túber, aplanado en L. leandri y tubuloso y alargado en L. mirabile; también difiere la coloración del interior del túber en estado fresco, rosado en L. leandri y blanco en L. mirabile subsp. bolivianum. Helosis y Ombrophytum (Mauseth & al., 1992; Hsiao & al., 1993), que además comparten con Lophophytum numerosas características anatómicas del túber: presencia de haces vasculares colaterales con cámbium, vasos con excrescencias, falta de meristemas, epidermis y estomas, entre las más destacadas.
Se han identificado en Balanophoraceae tres tipos de interfase entre parásito y hospedante: la más sencilla es un disco discreto donde los vasos de ambas especies están en contacto, observada en Helosis y Ombrophytum (Mauseth & al., 1992; Hsiao & al., 1993); la interfase más elaborada se encuentra en Langsdorffia (Hsiao & al. 1994) y Balanophora (Fagerlind, 1948; Gedalovich-Shedletzky & Kuijt, 1990; Hsiao & al., 1995), donde el sistema vascular del hospedante penetra en el túber y forma haces vasculares compuestos. El estado intermedio se presenta en Dactylanthus (Moore, 1940; Holzapfel, 2001) y Lophophytum (González & Mauseth, 2010; este estudio) donde los tejidos de ambos organismos se entrelazan en la interfase y forman un diseño coraloide denominado woodrose (González & Mauseth, 2010; Kuijt & Hansen, 2015).
En L. mirabile subsp. bolivianum, como en L. leandri (González & Mauseth, 2010), no se pudo identificar la forma en que se establece la conexión inicial del parásito con la raíz y tampoco se logró observar si se produce por la germinación de las semillas. A través de observaciones anatómicas, se puede inferir que la infección se produce temprano en el desarrollo de las raíces del hospedante, lo cual se evidencia por la presencia de células del parásito en el límite entre el crecimiento primario y secundario de la raíz. Estos grupos de células de L. mirabile subsp. bolivianum en el interior de A. colubrina var. cebil constituyen el endófito, de escaso desarrollo. La formación del cuerpo vegetativo exófito se observa cuando la raíz tiene crecimiento secundario: las células del parásito que se encuentran en la zona cambial de la raíz forman túberes que emergen de la peridermis del hospedante. Los nódulos endófitos de L. mirabile subsp. bolivianum que no se desarrollan, constituyen un reservorio de células capaces de originar nuevos túberes en años siguientes y un mecanismo de reproducción vegetativa. Similar situación fue descripta en la asociación de L. leandri y Parapiptadenia rigida por González & Mauseth (2010). Otros mecanismos de reproducción vegetativa fueron descritos en la familia: runners en Helosis y Ombrophytum (Mauseth & al., 1992; Hsiao & al., 1994), túberes ramificados en Thonningia Vahl y Langsdorffia (Mangenot, 1947; Hsiao & al., 1994) y raíces infecciosas en Dactylanthus (Moore, 1940; Holzapfel, 2001); ninguno de estos mecanismos está presente en Lophophytum.
Al formarse el cuerpo vegetativo exófito, queda definida la zona de interfase o límite donde las células de ambas especies se ponen en contacto (Heide-Jørgensen, 2008, 2013). Una característica compartida por la mayoría de las holoparásitas (Heide-Jørgensen, 2008, 2013) y encontrada en Lophophytum (Gonzalez & Mauseth, 2010; este trabajo), es la presencia de contacto directo entre elementos traqueales del parásito y del hospedante en la interfase, lo que se describe como puente xilemático por Heide-Jørgensen (2008). El presente trabajo no incluyó un estudio ultraestructural que permita identificar si el transporte de sustancias entre hospedante y parásito es exclusivamente apoplástico (entre los miembros de vasos) o si puede haber también movimiento de sustancias por vía simplástica, favorecido por el contacto directo observado entre células parenquimáticas de L. mirabile subsp. bolivianum y A. colubrina var. cebil.
El rasgo más destacable observado tras el análisis del cambio producido en la estructura del leño de la raíz de A. colubrina var. cebil tras ser infestada por el parásito, es que cuando L. mirabile subsp. bolivianum coloniza la zona cambial se afecta la distribución de los sistemas axial y radial típicos del crecimiento secundario provocado por el cámbium. Este cambio en la disposición de las células genera bucles de tejidos vasculares, donde los elementos conductores y las células parenquimáticas asociadas se disponen helicoidalmente formando remolinos y anillos cerrados de diferentes tamaños. Estas estructuras fueron descritas inicialmente como “vasos circulares” por Vochting (1892, 1918), en estudios experimentales de cambios de polaridad del xilema. Son estructuras poco usuales en plantas intactas, pero comunes en la parte basal o raíz de los tejidos cercanos a las heridas, en callos de plantas cultivadas in vitro o en la porción superior de una ramificación (Sachs & Cohen, 1982), o bien en tejidos ocupados por insectos gallícolas (González & Solís, 2015). Estos vasos circulares no participan en el transporte de agua, su presencia interrumpe el flujo xilemático hacia la parte apical del órgano y cambian la polaridad en el transporte de las auxinas (Sachs, 1981a, 1981b, 2005; Aloni, 1995, 2013). La presencia de estos vasos circulares en raíces de A. colubrina var. cebil afectada por la holoparásita podría ser la responsable del cese en el crecimiento en longitud de la raíz y la formación de una agalla leñosa en su extremo, también descrita en la asociación L. leandri y Parapiptadenia rigida. La consecuencia de esta interrupción es que los fotosintatos del árbol, que descienden por vía floemática, se acumulan en el extremo de la raíz, zona donde se encuentran los túberes y los nódulos endófitos de la holoparásita. Tal como sucede en muchas holoparásitas, no hay elementos floemáticos en esta zona (Joel & al., 2013). Esta combinación de características favorece al parásito, quien recibe todo los recursos, ya que en la interfase los elementos traqueales de ambos táxones se encuentran en contacto directo, lo que facilitaría el transporte de agua entre la raíz del hospedante y el parásito.
A nivel anatómico, la única diferencia observada entre la infección provocada por L. leandri a Parapiptadenia rigida y la de L. mirabile subsp. bolivianum en A. colubrina var. cebil, consiste en que en el último par de especies no se forman células taníferas asociadas al parénquima del xilema y el floema del hospedante, carácter muy destacado en Parapiptadenia rigida. La presencia de estas células está asociada comúnmente con la resistencia al ataque de patógenos (Evert, 2006).
A pesar que el hospedante de L. leandri es Parapiptadenia rigida, un árbol de la familia Fabaceae como A. colubrina var. cebil, las modificaciones que ambas especies de Lophophytum producen en las raíces de sus hospedantes son virtualmente idénticas. La pérdida de identidad del sistema radial y axial del crecimiento secundario de la raíz lleva a la formación de bucles de xilema donde la matriz de fibras es reemplazada por parénquima lignificado. La agalla leñosa formada en la raíz del árbol parasitado concentra nutrientes que descienden por vía floemática, los cuales llegan directamente al parásito, cuyo cuerpo vegetativo acumula una notable cantidad de reservas, tanto en forma de almidón como de grasas. Podemos concluir que la infección de L. mirabile subsp. bolivianum causa profundos cambios anatómicos en el desarrollo de la madera de A. colubrina, los cuales favorecen el éxito del parásito. La única reacción defensiva observada es que el hospedante deja de producir miembros de tubos cribosos cerca del sitio de infección.
AGRADECIMIENTOSTOP
A los conservadores de los herbarios, por el acceso a los materiales. Este trabajo fue realizado con un subsidio de la Universidad
Nacional del Nordeste (PICTO 199/2011).
REFERENCIAS BIBLIOGRÁFICASTOP
| ○ |
Aloni, R. 1995. The induction of vascular tissues by auxin and cytokinin. In: Davies, P.J. (ed.), Plant hormones: physiology, biochemistry and molecular biology: 531-546. Holanda. https://dx.doi.org/10.1007/978-94-011-0473-9_25.
|
| ○ |
Aloni, R. 2013. The role of hormones in controlling vascular differentiation. In: Fromm, J. (ed.), Plant cell monographs: cellular aspects of wood formation: 99-140. Berlín. https://dx.doi.org/10.1007/978-3-642-36491-4_4.
|
| ○ |
Bellot, S. & Renner, S. 2014. The systematics of the worldwide endoparasite family Apodanthaceae (Cucurbitales), with a key, a map, and color photos of most species. PhytoKeys 36: 41-57. https://dx.doi.org/10.3897/phytokeys.36.7385.
|
| ○ |
Carlquist, S. 2001. Comparative wood anatomy: Systematic, ecological and evolutionary aspects of Dicotyledon wood, 2nd ed. Springer-Verlag. https://dx.doi.org/10.1007/978-3-662-04578-7.
|
| ○ |
Cocucci, A.E. 1984. Hydnoraceae. In: Hunziker, A.T. (ed.), Los géneros de Fanerógamas de Argentina. Boletín de la Sociedad Argentina de Botánica 23: 164.
|
| ○ |
Evert, R.E. 2006. Esau’s plant anatomy, meristems, cells, and tissues of the plant body: Their structure, function, and development. Wiley Press, Nueva York.
|
| ○ |
Fagerlind, F. 1948. Bau und Entwicklung der vegetativen Organe von Balanophora. Kungliga Svenska Vetenskapsakademiens Handlingar III, 25: 1-72.
|
| ○ |
Gedalovich-Shedletzky, E. & Kuijt, J. 1990. An ultrastructural study of the tuber strands of Balanophora (Balanophoraceae). Canadian Journal of Botany 68: 1271-1279. https://dx.doi.org/10.1139/b90-162.
|
| ○ |
González, A.M. & Cristóbal, C.L. 1997. Anatomía y ontogenia de semillas de Helicteres lhotzkyana (Sterculiaceae). Bonplandia 9(3-4): 287-294.
|
| ○ |
González, A.M. & Mauseth, J.D. 2010. Morphogenesis is highly aberrant in the vegetative body of the holoparasite Lophophytum leandri (Balanophoraceae): All typical vegetative organs are absent and many tissues are highly modified. International Journal of Plant Science 171(5): 499-508. https://dx.doi.org/10.1086/651947.
|
| ○ |
González, A.M. & Solís, S.M. 2015. Anatomía y morfogénesis de las agallas producidas por Leptocybe invasa en plantas de Eucalyptus. Boletín de la Sociedad Argentina de Botánica 50(2): 141-151.
|
| ○ |
Hansen, B. 1980. Balanophoraceae. Flora Neotropica, Monograph 23: 1-80.
|
| ○ |
Heide-Jørgensen, H.S. 2008. Parasitic flowering plants. Holanda. https://dx.doi.org/10.1163/ej.9789004167506.i-438.
|
| ○ |
Heide-Jørgensen, H.S. 2013. The Parasitic Syndrome in Higher Plants. In: Joel, D.M. & al. (eds.), Parasitic Orobanchaceae. Parasitic Mechanisms and Control Strategies. Berlín, Heidelberg.
|
| ○ |
Holzapfel, S. 2001. Studies of the New Zealand Root-Parasite Dactylanthus taylorii (Balanophoraceae). Englera 22: 1-176. https://dx.doi.org/10.2307/3776780.
|
| ○ |
Hsiao, S.C., Mauseth, J.D. & Gómez, L.D. 1993. Growth and anatomy of the vegetative body of the parasitic angiosperm Helosis cayennensis (Balanophoraceae). Bulletin of the Torrey Botanical Club 120: 295-309. https://dx.doi.org/10.2307/2996994.
|
| ○ |
Hsiao, S.C., Mauseth, J.D. & Gómez, L.D. 1994 Growth and anatomy of the vegetative body of the parasite angiosperm Langsdorffia hypogaea (Balanophoraceae). Bulletin of the Torrey Botanical Club 121: 24-39. https://dx.doi.org/10.2307/2996881.
|
| ○ |
Hsiao, S.C., Mauseth, J.D. & Peng, C.I. 1995. Composite bundles, the host/parasite interface in the holoparasitic angiosperms Langsdorffia and Balanophora (Balanophoraceae). American Journal of Botany 82: 81-91. https://dx.doi.org/10.2307/2445790.
|
| ○ |
Johansen, D.A. 1940. Plant Microtechnique. Nueva York.
|
| ○ |
Kuijt, J. 1969 The biology of parasitic flowering plants. California.
|
| ○ |
Kuijt, J. & Hansen, B. 2015. Balanophorales. In: Kubitzki, K. (ed.), Flowering Plants. Eudicots, The Families and Genera of Vascular Plants Volume XII, Santalales, Balanophorales: 192-208. Suiza.
|
| ○ |
Luque, R.H., Sousa, C. & Kraus, J.E. 1996. Métodos de coloraçao de Roeser (1972)-modificado- e Kropp (1972) visando a subtituicao do azul de astra por azul de alciaô 8 GS ou 8 GX. Acta Botánica Brasilica 10: 199-212.
|
| ○ |
Mangenot, G. 1947. Recherches sur l’organisation dune Balanophoracée: Thonningia coccinea. Revue générale de Botanique 54: 201-294.
|
| ○ |
Martínez, O.G., Barrandeguy, M.E., García, M.V., Cacharani, D.A. & Prado, D.E. 2013. Presencia de Anadenanthera colubrina var. colubrina (Fabaceae, Mimosoideae) en Argentina. Darwiniana, nueva serie 1(2): 279-288. https://dx.doi.org/10.14522/darwiniana.2013.12.536.
|
| ○ |
Mauseth, J.D., Hsiao, S.C. & Montenegro, G. 1992. Vegetative body of the parasitic angiosperm Ombrophytum subterraneum (Balanophoraceae). Bulletin of the Torrey Botanical Club 119: 407-417. https://dx.doi.org/10.2307/2996729.
|
| ○ |
Meijer, W. 1993a. Hydnoraceae. In: Kubitzki, K. & al. (eds.), The families and genera of vascular plants, volume II, Flowering Plants. Dicotyledons. Magnoliid, Hamamelid and Caryophyllid Families: 341-343. Berlín.
|
| ○ |
Meijer W. 1993b. Rafflesiaceae. In: Kubitzki, K. & al. (eds.), The families and genera of vascular plants, volume II, Flowering Plants. Dicotyledons. Magnoliid, Hamamelid and Caryophyllid Families: 557-563. Berlín.
|
| ○ |
Moore, L.B. 1940. The structure and life-history of the root parasite Dactylanthus taylori Hook f. New Zealand Journal of Science and Technology 21-22: 206B–224B.
|
| ○ |
Musselman, L.J. & Press, M.C. 1995. Introduction to parasitic plants. In: Press, M.C. & Graves, J.D. (eds.), Parasitic Plants. pp. 1-13. Londres.
|
| ○ |
Nickrent, D.L. [2015]. The parasitic plant connection, Balanophoraceae. http://www.parasiticplants.siu.edu.
|
| ○ |
Nickrent, D.L. & Musselman, L.J. 2004. Introduction to parasitic flowering plants. The Plant Health Instructor 13: 300-315. https://dx.doi.org/10.1094/phi-i-2004-0330-01.
|
| ○ |
Nickrent, D.L., Malécot, V., Vidal-Russell, R. & Der, J.P. 2010. A revised classification of Santalales. Taxon 59: 538-558.
|
| ○ |
Ruzin, S.E. 1999. Plant microtechnique and Microscopy. Oxford University Press.
|
| ○ |
Sachs, T. 1981a. The control of the patterned differentiation of vascular tissues. Advances in Botanical Research 9: 151-262. https://dx.doi.org/10.1016/S0065-2296(08)60351-1.
|
| ○ |
Sachs, T. 1981b. Polarity changes and tissue organization in plants. In: Schweiger, H.G. (ed.), International Cell Biology. pp. 489-496. Berlín.
|
| ○ |
Sachs, T. 2005. Pattern formation in plant tissues. Cambridge University Press.
|
| ○ |
Sachs, T. & Cohen, D. 1982. Circular vessels and the control of vascular differentiation in plants. Differentiation 21: 22-26. https://dx.doi.org/10.1111/j.1432-0436.1982.tb01189.x.
|
| ○ |
Sato, H.A. 2015 (inéd.). Anatomía reproductiva de las especies de Lophophytum Schott & Endl. (Balanophoraceae) de la Argentina y revisión taxonómica del género en América. Tesis doctoral. Universidad Nacional del Nordeste. Corrientes, Argentina.
|
| ○ |
Shivamurthy, G.R., Arekal, G.D. & Swamy, B.G.L .1981. Establishment, structure and morphology of the tuber of Balanophora. Annals of Botany 47: 735-745.
|
| ○ |
Tennakoon Kushan U., Bolin, J.F., Musselman, L.J. & Maass, E. 2007. Structural attributes of the hypogeous holoparasite Hydnora triceps Drège & Meyer (Hydnoraceae). American Journal of Botany 94(9): 1439-1449. https://dx.doi.org/10.3732/ajb.94.9.1439.
|
| ○ |
Vöchting, H. 1892. Über Transplantation am Pflanzenkörper. Verlag H. Laupp’schen Buchhandlung, Tubinga.
|
| ○ |
Vöchting, H. 1918. Untersuchungen zur experimentellen anatomie und pathologie des pflanzenkörpers. II Die Polarität der Gewächse. Verlag H. Laupp’schen Buchhandlung, Tubinga.
|
| ○ |
Xifreda, C.C. 1999. Balanophoraceae. In: Zuloaga, F. & Morrone, O. (eds.), Catálogo de las plantas vasculares de la Rep. Argentina II. Monographs in Systematic Botany from the Missouri Botanical Garden 74: 353-354.
|
| ○ |
Zuloaga, F.O., Morrone, O.N., Belgrano, M.J., Marticorena, C. & Marchesi, E. (eds.). 2008. Catálogo de las plantas vasculares del Cono Sur. Monographs in Systematic Botany from the Missouri Botanical Garden 107: 1-3348.
|
Fig. 1. Morfología de Lophophytum mirabile subsp. bolivianum y Anadenanthera colubrina var. cebil: a, b, túber de L. mirabile subsp. bolivianum con inflorescencia jóven; c, túber fresco mostrando matriz interna; d, detalle de inflorescencia emergiendo entre verrugas; e, detalle de zona verrugosa y matriz en túber fresco; f, zonación en túber fijado en FAA; g, interfase entre L. mirabile subsp. bolivianum y A. colubrina en vista superficial; h, detalle del diseño coraloide de la interfase; i, inflorescencia, emergencia del suelo; j, raíz con túber portador de 5 inflorescencias aún cubiertas por escamas; k, túber con dos inflorescencias desprovistas de escamas, mostrando raquices con flores pistiladas (p), estaminadas (e) y lugar de la interfase (flecha). Abreviaturas: m: matriz, zv: zona verrugosa, zt: zona de transición. Escalas: a-d, g = 1cm; f = 2,5 cm; e, h = 1mm; i-k = 10 cm.